よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
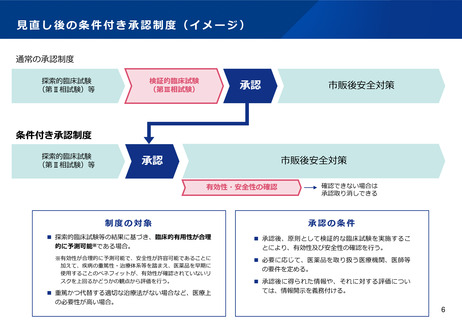
(6)省令等の改正により対応可能な製薬業界からの要望への検討事項
申請手続きの合理化
•
承認申請時の製造販売業の許可証の添付を不要とする。
•
テレワーク等の働き方の多様化を踏まえ、医薬品の製造業、製造販売業、卸売販売業の許可申請時に、製造管理者、総括製造販売
責任者、営業所管理者の居住地の記載を不要とする。
•
医薬品の製造販売業・製造業の許可台帳の記載事項及び医薬品の総括製造販売責任者・製造管理者の変更の届出をしなければなら
ない事項から、他の製造販売業・製造業の許可・廃止に関する事項を削除する。
•
医薬品の原薬等登録原簿の軽微な変更の範囲について、医薬品の承認事項の変更手続きにおける軽微な変更の範囲と同様に、「規
格及び試験方法に掲げる事項の削除又は規格の変更」を含めるよう見直す。
•
医薬品の製造販売承認の承継の際に、製造業の許可・認定に関する資料を承継しなければならない規定を削除する。
輸出用医薬品関係の整備
•
基準確認証の対象に「輸出用の医薬品等の製造業者」を加え、輸出証明(CPP、GMP証明)発給に際して、基準確認証での証明書
発給を可能とする。
•
輸出証明書の発給を承認後速やかに行うこととする。必要に応じて承認書における英語記載などを検討する。
GCP関係の運用改善
•
GCP調査の実施について、リスクに応じた合理化を検討する。また、治験実施医療機関の選定の一環として、SMO(Site
Management Organization:治験施設支援機関)に対する治験依頼者の監督強化を検討する。
19
申請手続きの合理化
•
承認申請時の製造販売業の許可証の添付を不要とする。
•
テレワーク等の働き方の多様化を踏まえ、医薬品の製造業、製造販売業、卸売販売業の許可申請時に、製造管理者、総括製造販売
責任者、営業所管理者の居住地の記載を不要とする。
•
医薬品の製造販売業・製造業の許可台帳の記載事項及び医薬品の総括製造販売責任者・製造管理者の変更の届出をしなければなら
ない事項から、他の製造販売業・製造業の許可・廃止に関する事項を削除する。
•
医薬品の原薬等登録原簿の軽微な変更の範囲について、医薬品の承認事項の変更手続きにおける軽微な変更の範囲と同様に、「規
格及び試験方法に掲げる事項の削除又は規格の変更」を含めるよう見直す。
•
医薬品の製造販売承認の承継の際に、製造業の許可・認定に関する資料を承継しなければならない規定を削除する。
輸出用医薬品関係の整備
•
基準確認証の対象に「輸出用の医薬品等の製造業者」を加え、輸出証明(CPP、GMP証明)発給に際して、基準確認証での証明書
発給を可能とする。
•
輸出証明書の発給を承認後速やかに行うこととする。必要に応じて承認書における英語記載などを検討する。
GCP関係の運用改善
•
GCP調査の実施について、リスクに応じた合理化を検討する。また、治験実施医療機関の選定の一環として、SMO(Site
Management Organization:治験施設支援機関)に対する治験依頼者の監督強化を検討する。
19