よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
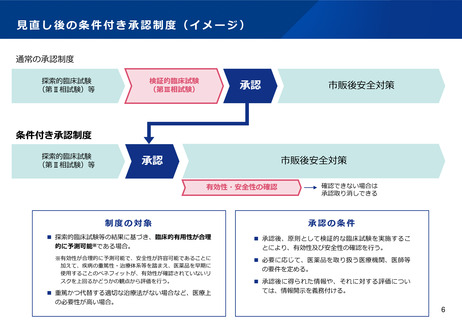
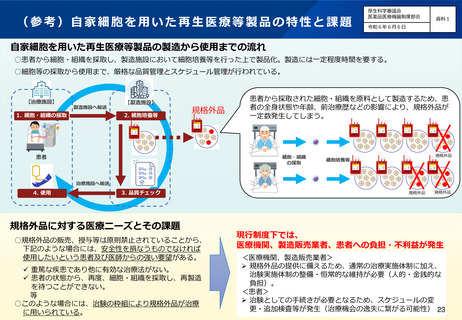
(7)再生医療等製品の特性を踏まえた治療アクセスの改善
検討の方向性(案)
•
自家細胞を用いた再生医療等製品については、製品の安全性が確保されていることを大前提として、患者の求
めに応じたものであること、含量などが規格外であることにより推定される効果の低下に比して疾患の重篤性
や患者の状態から治療を受ける機会の損失の影響が多大であること、医師が有用性を認めた提供であること、
など、一定の要件を満たす場合に限り、いわゆる規格外品の販売・授与等を許容することとしてはどうか。
•
ただし、治療に用いられるものであることから、市販品と同様に、製造販売後安全管理等が適切に行われるこ
とを条件とする。
•
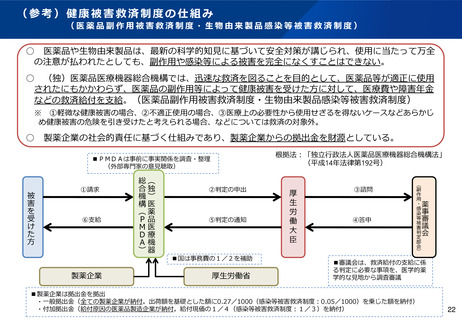
製品の安全性が確保されていることを大前提として、医師が有用と認めた提供であること等の一定の要件を満
たした上で使用されることから、適正に使用される許可再生医療等製品として、医薬品副作用被害救済制度※の
対象となる。
※ 機構が前年度に副作用救済給付の支給を決定した者に係る疾病、障害又は死亡の原因となった許可再生医療等製品の製造販売業者は、付加拠出
金の拠出を行う(給付現価の1/4を納付)
•
規格外品であったとしても製品自体は薬事承認を受けたものであり、当該承認の内容に従い用いるものである
ことから、再生医療等の安全性の確保等に関する法律における「再生医療等技術」から再生医療等製品が除か
れている現行の棲み分けを変更するものではない。
<再生医療等の安全性の確保等に関する法律>
(定義)
第二条 この法律において「再生医療等」とは、再生医療等技術を用いて行われる医療(医薬品、医療機器等の品質、有効性及び安全性の確保等
に関する法律(昭和三十五年法律第百四十五号。以下「医薬品医療機器等法」という。)第八十条の二第二項に規定する治験に該当するものを
除く。)をいう。
2 この法律において「再生医療等技術」とは、次に掲げる医療に用いられることが目的とされている医療技術であって、細胞加工物を用いるも
の(細胞加工物として再生医療等製品(医薬品医療機器等法第二十三条の二十五又は第二十三条の三十七の承認を受けた再生医療等製品をいう。
第四項において同じ。)のみを当該承認の内容に従い用いるものを除く。)のうち、その安全性の確保等に関する措置その他のこの法律で定め
る措置を講ずることが必要なものとして政令で定めるものをいう。
21
検討の方向性(案)
•
自家細胞を用いた再生医療等製品については、製品の安全性が確保されていることを大前提として、患者の求
めに応じたものであること、含量などが規格外であることにより推定される効果の低下に比して疾患の重篤性
や患者の状態から治療を受ける機会の損失の影響が多大であること、医師が有用性を認めた提供であること、
など、一定の要件を満たす場合に限り、いわゆる規格外品の販売・授与等を許容することとしてはどうか。
•
ただし、治療に用いられるものであることから、市販品と同様に、製造販売後安全管理等が適切に行われるこ
とを条件とする。
•
製品の安全性が確保されていることを大前提として、医師が有用と認めた提供であること等の一定の要件を満
たした上で使用されることから、適正に使用される許可再生医療等製品として、医薬品副作用被害救済制度※の
対象となる。
※ 機構が前年度に副作用救済給付の支給を決定した者に係る疾病、障害又は死亡の原因となった許可再生医療等製品の製造販売業者は、付加拠出
金の拠出を行う(給付現価の1/4を納付)
•
規格外品であったとしても製品自体は薬事承認を受けたものであり、当該承認の内容に従い用いるものである
ことから、再生医療等の安全性の確保等に関する法律における「再生医療等技術」から再生医療等製品が除か
れている現行の棲み分けを変更するものではない。
<再生医療等の安全性の確保等に関する法律>
(定義)
第二条 この法律において「再生医療等」とは、再生医療等技術を用いて行われる医療(医薬品、医療機器等の品質、有効性及び安全性の確保等
に関する法律(昭和三十五年法律第百四十五号。以下「医薬品医療機器等法」という。)第八十条の二第二項に規定する治験に該当するものを
除く。)をいう。
2 この法律において「再生医療等技術」とは、次に掲げる医療に用いられることが目的とされている医療技術であって、細胞加工物を用いるも
の(細胞加工物として再生医療等製品(医薬品医療機器等法第二十三条の二十五又は第二十三条の三十七の承認を受けた再生医療等製品をいう。
第四項において同じ。)のみを当該承認の内容に従い用いるものを除く。)のうち、その安全性の確保等に関する措置その他のこの法律で定め
る措置を講ずることが必要なものとして政令で定めるものをいう。
21