よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
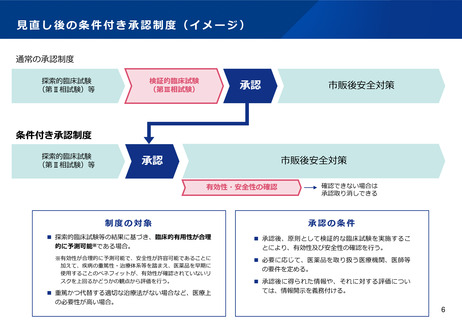
(2)医療上の必要性の高い医薬品等への早期アクセスの確保
背景・課題
•
医療上の必要性の高い希少・重篤な疾患に対する医薬品等については、検証的試験※の結果を待たず、探索的な
試験(いわゆる第Ⅱ相までの試験)結果に基づいて薬事承認を行う制度が、日米欧において設けられている。
※ 医薬品の有効性及び安全性を検証するための試験であり、そのデザインは医薬品ごとに異なる。いわゆる第Ⅲ相試験。
•
しかしながら、日本の条件付き承認制度は、承認の取り消し規定がないため、明らかな効果が確認できた探索
的試験(第Ⅱ相試験)の結果に基づく場合や、検証的試験の実施途中である場合の適用を想定したものとなっ
ている。そのため、日本においては、米国のAccelerated Approval(迅速承認)や EUの Conditional
Approval のような、探索的な試験結果であっても有効性が期待できると合理的に判断された状況であれば早期
に適用される仕組みと比べて、制度創設後の承認件数が少ない。こうした状況を背景に、製薬業界やベン
チャー企業、患者団体等より、その運用の拡大を求める声がある。
•
これを踏まえ、「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」において検討
を行い、現行の条件付き承認制度について、適応要件を柔軟に解釈できるよう運用を見直すことなどの対応を
することとしているが、あわせて、制度的枠組みのあり方については、別途検討を進めることとされた。
4
背景・課題
•
医療上の必要性の高い希少・重篤な疾患に対する医薬品等については、検証的試験※の結果を待たず、探索的な
試験(いわゆる第Ⅱ相までの試験)結果に基づいて薬事承認を行う制度が、日米欧において設けられている。
※ 医薬品の有効性及び安全性を検証するための試験であり、そのデザインは医薬品ごとに異なる。いわゆる第Ⅲ相試験。
•
しかしながら、日本の条件付き承認制度は、承認の取り消し規定がないため、明らかな効果が確認できた探索
的試験(第Ⅱ相試験)の結果に基づく場合や、検証的試験の実施途中である場合の適用を想定したものとなっ
ている。そのため、日本においては、米国のAccelerated Approval(迅速承認)や EUの Conditional
Approval のような、探索的な試験結果であっても有効性が期待できると合理的に判断された状況であれば早期
に適用される仕組みと比べて、制度創設後の承認件数が少ない。こうした状況を背景に、製薬業界やベン
チャー企業、患者団体等より、その運用の拡大を求める声がある。
•
これを踏まえ、「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」において検討
を行い、現行の条件付き承認制度について、適応要件を柔軟に解釈できるよう運用を見直すことなどの対応を
することとしているが、あわせて、制度的枠組みのあり方については、別途検討を進めることとされた。
4