よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
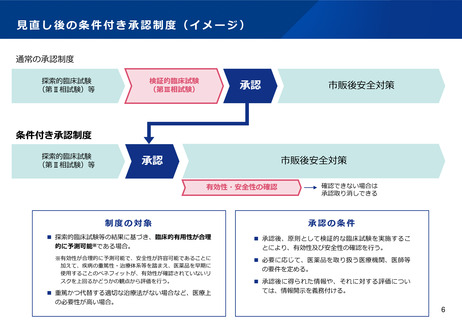
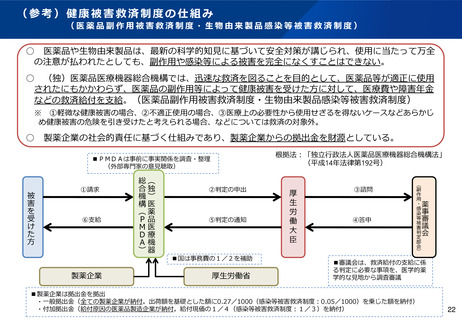
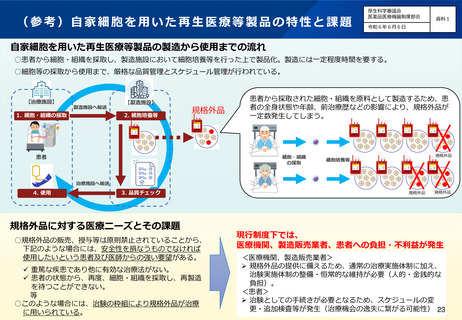
(4)医薬品等の供給不足を踏まえたアクセス改善に向けた制度の見直し
③日本薬局方に関する対応について-1
日本薬局方について
•
日本薬局方は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)第41条により、医薬品の性状及び品質の適正
を図るため、厚生労働大臣が薬事審議会の意見を聴いて定めた医薬品の規格基準書であって、日本薬局方の構成は通則、生薬総則、製剤総則、
一般試験法及び医薬品各条からなり、収載医薬品については我が国で繁用されている医薬品が中心となっている。
•
日本薬局方は100年有余の歴史があり、初版は明治19年6月に公布され、今日に至るまで医薬品の開発、試験技術の向上に伴って改訂が重ね
られ、現在では、第十八改正日本薬局方が公布されている。
背景
•
日本薬局方は、我が国におけるエッセンシャルな医薬品において遵守しなければならない品質の強制規格として、我が国の医薬品及び医薬品
産業の質的向上を牽引してきた役割が大きい。また、公開された規格集として、現場での品質試験・検査などの確認の用にも供するものであ
り、製造と使用の両面から医薬品の品質を確認できることは、薬局方を有している国にのみ可能な品質確保の仕組みである。なお、最新の科
学技術や欧米薬局方との整合性を考慮して、概ね5年に1回の大改訂及び2回の小改訂を行っている。
•
旧薬事法では、日本薬局方に収載されている医薬品(原薬・製剤)は、大臣の個別承認なく製造・販売等が可能であった。しかし、昭和55年
の薬事法改正により、日本薬局方に収載されている医薬品であっても、個別に大臣の承認を取得することが求められることになった。
•
それ以降、強制規格の性質として薬機法第56条第1号において「日本薬局方に収められている医薬品であつて、その性状又は品質が日本薬局
方で定める基準に適合しないもの」は販売等が禁止されており、日本薬局方に収載されている医薬品の場合は、たとえ同じ成分であっても、
日本薬局方以外の規格を用いた医薬品の承認は認められない。(承認書でも、同一成分で日本薬局方以外の規格を記載することが認められな
い)
•
他方で、日本と同等の薬事規制を実施している国・地域で制定された薬局方も存在し、それらには適合するものの日本薬局方の規格とは異な
る医薬品成分等が我が国において流通出来ないことについて、特に安定供給が求められる場合に、産業界からの批判もある。
•
なお、欧米の薬局方制度においては、原則として自地域の薬局方への適合が求められているものの、非適合の成分についても、個別に審査さ
れることでその柔軟な使用が認められている。
12
③日本薬局方に関する対応について-1
日本薬局方について
•
日本薬局方は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)第41条により、医薬品の性状及び品質の適正
を図るため、厚生労働大臣が薬事審議会の意見を聴いて定めた医薬品の規格基準書であって、日本薬局方の構成は通則、生薬総則、製剤総則、
一般試験法及び医薬品各条からなり、収載医薬品については我が国で繁用されている医薬品が中心となっている。
•
日本薬局方は100年有余の歴史があり、初版は明治19年6月に公布され、今日に至るまで医薬品の開発、試験技術の向上に伴って改訂が重ね
られ、現在では、第十八改正日本薬局方が公布されている。
背景
•
日本薬局方は、我が国におけるエッセンシャルな医薬品において遵守しなければならない品質の強制規格として、我が国の医薬品及び医薬品
産業の質的向上を牽引してきた役割が大きい。また、公開された規格集として、現場での品質試験・検査などの確認の用にも供するものであ
り、製造と使用の両面から医薬品の品質を確認できることは、薬局方を有している国にのみ可能な品質確保の仕組みである。なお、最新の科
学技術や欧米薬局方との整合性を考慮して、概ね5年に1回の大改訂及び2回の小改訂を行っている。
•
旧薬事法では、日本薬局方に収載されている医薬品(原薬・製剤)は、大臣の個別承認なく製造・販売等が可能であった。しかし、昭和55年
の薬事法改正により、日本薬局方に収載されている医薬品であっても、個別に大臣の承認を取得することが求められることになった。
•
それ以降、強制規格の性質として薬機法第56条第1号において「日本薬局方に収められている医薬品であつて、その性状又は品質が日本薬局
方で定める基準に適合しないもの」は販売等が禁止されており、日本薬局方に収載されている医薬品の場合は、たとえ同じ成分であっても、
日本薬局方以外の規格を用いた医薬品の承認は認められない。(承認書でも、同一成分で日本薬局方以外の規格を記載することが認められな
い)
•
他方で、日本と同等の薬事規制を実施している国・地域で制定された薬局方も存在し、それらには適合するものの日本薬局方の規格とは異な
る医薬品成分等が我が国において流通出来ないことについて、特に安定供給が求められる場合に、産業界からの批判もある。
•
なお、欧米の薬局方制度においては、原則として自地域の薬局方への適合が求められているものの、非適合の成分についても、個別に審査さ
れることでその柔軟な使用が認められている。
12