よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
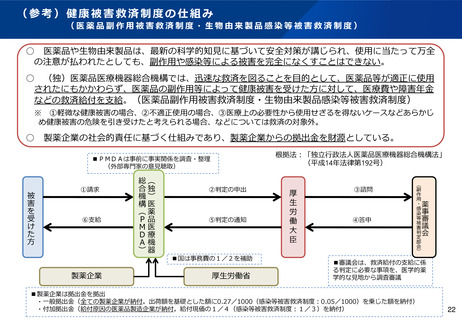
(参考)健康被害救済制度の仕組み
(医薬品副作用被害救済制度・生物由来製品感染等被害救済制度)
○ 医薬品や生物由来製品は、最新の科学的知見に基づいて安全対策が講じられ、使用に当たって万全
の注意が払われたとしても、副作用や感染等による被害を完全になくすことはできない。
○ (独)医薬品医療機器総合機構では、迅速な救済を図ることを目的として、医薬品等が適正に使用
されたにもかかわらず、医薬品の副作用等によって健康被害を受けた方に対して、医療費や障害年金
などの救済給付を支給。(医薬品副作用被害救済制度・生物由来製品感染等被害救済制度)
※ ①軽微な健康被害の場合、②不適正使用の場合、③医療上の必要性から使用せざるを得ないケースなどあらかじ
め健康被害の危険を引き受けたと考えられる場合、などについては救済の対象外。
○
製薬企業の社会的責任に基づく仕組みであり、製薬企業からの拠出金を財源としている。
根拠法:「独立行政法人医薬品医療機器総合機構法」
(平成14年法律第192号)
■PMDAは事前に事実関係を調査・整理
(外部専門家の意見聴取)
被
害
を
受
け
た
方
①請求
⑥支給
総(
合独
機)
構医
(薬
P品
M医
D療
A機
)器
②判定の申出
⑤判定の通知
■国は事務費の1/2を補助
製薬企業
厚生労働省
厚
生
労
働
大
臣
③諮問
④答申
(
副
作
用
・薬
感
染事
等審
被
害議
判会
定
部
会
)
■審議会は、救済給付の支給に係
る判定に必要な事項を、医学的薬
学的な見地から調査審議
■製薬企業は拠出金を拠出
・一般拠出金(全ての製薬企業が納付。出荷額を基礎とした額に0.27/1000(感染等被害救済制度:0.05/1000)を乗じた額を納付)
・付加拠出金(給付原因の医薬品製造企業が納付。給付現価の1/4(感染等被害救済制度:1/3)を納付)
22
(医薬品副作用被害救済制度・生物由来製品感染等被害救済制度)
○ 医薬品や生物由来製品は、最新の科学的知見に基づいて安全対策が講じられ、使用に当たって万全
の注意が払われたとしても、副作用や感染等による被害を完全になくすことはできない。
○ (独)医薬品医療機器総合機構では、迅速な救済を図ることを目的として、医薬品等が適正に使用
されたにもかかわらず、医薬品の副作用等によって健康被害を受けた方に対して、医療費や障害年金
などの救済給付を支給。(医薬品副作用被害救済制度・生物由来製品感染等被害救済制度)
※ ①軽微な健康被害の場合、②不適正使用の場合、③医療上の必要性から使用せざるを得ないケースなどあらかじ
め健康被害の危険を引き受けたと考えられる場合、などについては救済の対象外。
○
製薬企業の社会的責任に基づく仕組みであり、製薬企業からの拠出金を財源としている。
根拠法:「独立行政法人医薬品医療機器総合機構法」
(平成14年法律第192号)
■PMDAは事前に事実関係を調査・整理
(外部専門家の意見聴取)
被
害
を
受
け
た
方
①請求
⑥支給
総(
合独
機)
構医
(薬
P品
M医
D療
A機
)器
②判定の申出
⑤判定の通知
■国は事務費の1/2を補助
製薬企業
厚生労働省
厚
生
労
働
大
臣
③諮問
④答申
(
副
作
用
・薬
感
染事
等審
被
害議
判会
定
部
会
)
■審議会は、救済給付の支給に係
る判定に必要な事項を、医学的薬
学的な見地から調査審議
■製薬企業は拠出金を拠出
・一般拠出金(全ての製薬企業が納付。出荷額を基礎とした額に0.27/1000(感染等被害救済制度:0.05/1000)を乗じた額を納付)
・付加拠出金(給付原因の医薬品製造企業が納付。給付現価の1/4(感染等被害救済制度:1/3)を納付)
22