よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
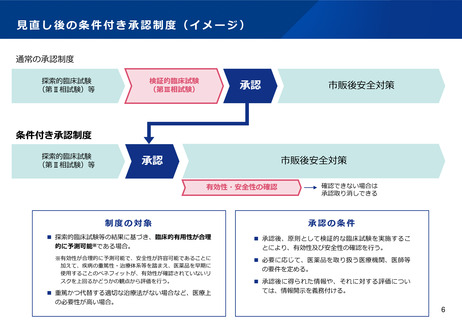
見直し後の条件付き承認制度(イメージ)
通常の承認制度
探索的臨床試験
(第Ⅱ相試験)等
検証的臨床試験
(第Ⅲ相試験)
承認
市販後安全対策
条件付き承認制度
探索的臨床試験
(第Ⅱ相試験)等
承認
市販後安全対策
有効性・安全性の確認
確認できない場合は
承認取り消しできる
制度の対象
承認の条件
◼ 探索的臨床試験等の結果に基づき、臨床的有用性が合理
的に予測可能※である場合。
◼ 承認後、原則として検証的な臨床試験を実施するこ
とにより、有効性及び安全性の確認を行う。
※有効性が合理的に予測可能で、安全性が許容可能であることに
加えて、疾病の重篤性・治療体系等を踏まえ、医薬品を早期に
使用することのベネフィットが、有効性が確認されていないリ
スクを上回るかどうかの観点から評価を行う。
◼ 必要に応じて、医薬品を取り扱う医療機関、医師等
の要件を定める。
◼ 重篤かつ代替する適切な治療法がない場合など、医療上
の必要性が高い場合。
◼ 承認後に得られた情報や、それに対する評価につい
ては、情報開示を義務付ける。
6
通常の承認制度
探索的臨床試験
(第Ⅱ相試験)等
検証的臨床試験
(第Ⅲ相試験)
承認
市販後安全対策
条件付き承認制度
探索的臨床試験
(第Ⅱ相試験)等
承認
市販後安全対策
有効性・安全性の確認
確認できない場合は
承認取り消しできる
制度の対象
承認の条件
◼ 探索的臨床試験等の結果に基づき、臨床的有用性が合理
的に予測可能※である場合。
◼ 承認後、原則として検証的な臨床試験を実施するこ
とにより、有効性及び安全性の確認を行う。
※有効性が合理的に予測可能で、安全性が許容可能であることに
加えて、疾病の重篤性・治療体系等を踏まえ、医薬品を早期に
使用することのベネフィットが、有効性が確認されていないリ
スクを上回るかどうかの観点から評価を行う。
◼ 必要に応じて、医薬品を取り扱う医療機関、医師等
の要件を定める。
◼ 重篤かつ代替する適切な治療法がない場合など、医療上
の必要性が高い場合。
◼ 承認後に得られた情報や、それに対する評価につい
ては、情報開示を義務付ける。
6