よむ、つかう、まなぶ。
資料1:臨床研究中核病院の承認要件見直しについて (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
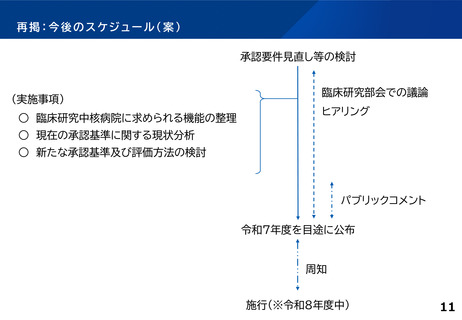
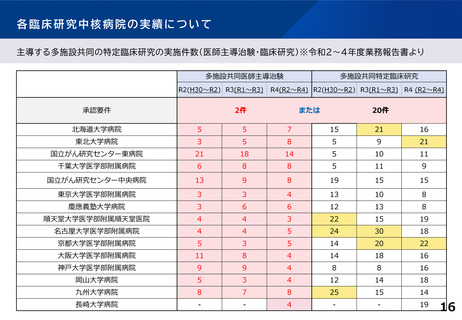
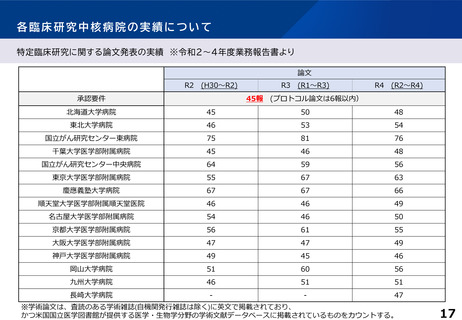
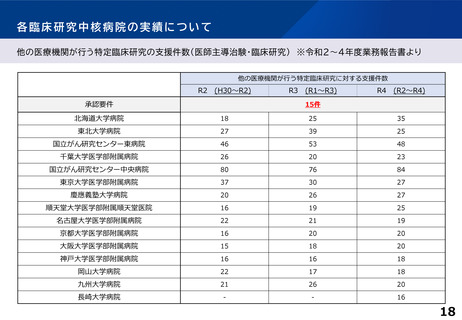
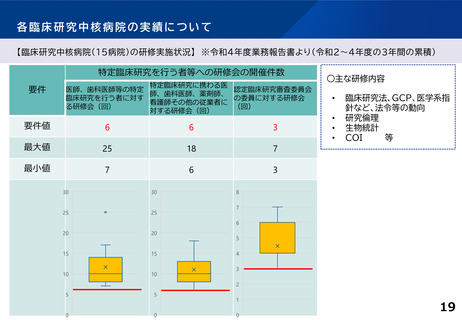
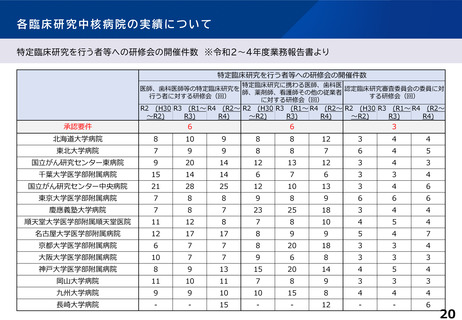
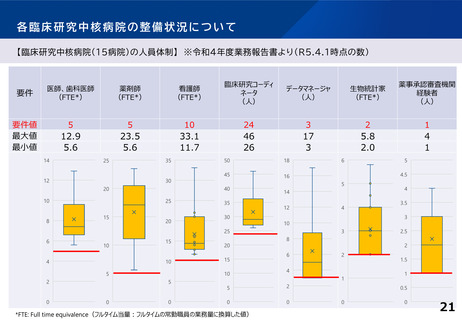
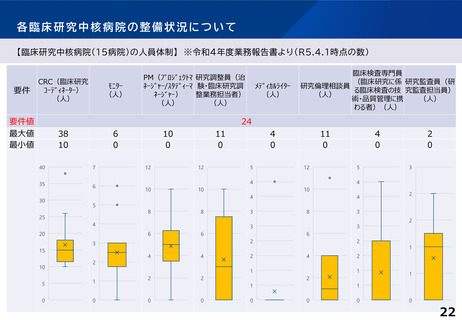
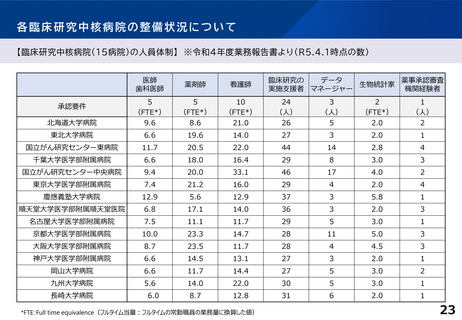
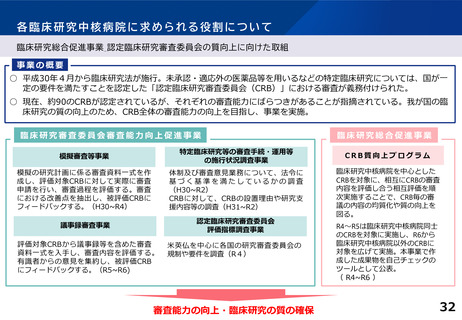
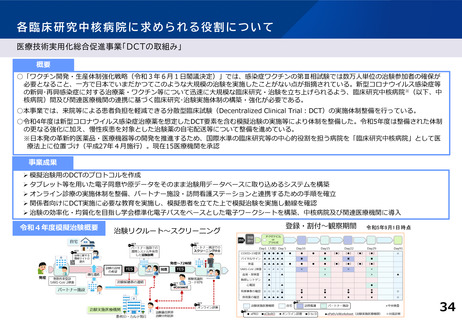
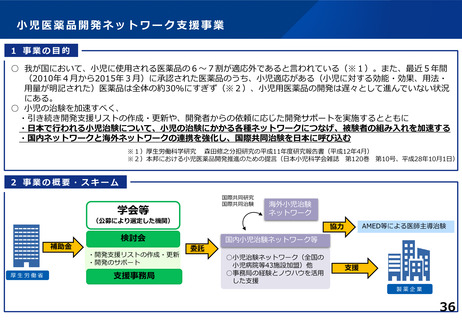
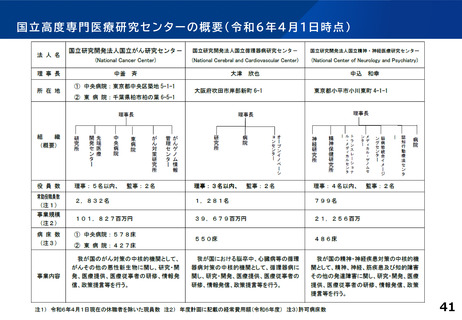
臨床研究中核病院の承認要件に関する課題と論点(案)③
課
題
○ 臨床試験が進みにくい特定領域(難病・希少疾病、小児疾患等)における研究を推
進するための取組として、特定領域型の臨床研究中核病院を位置づけたが、承認
実績はない。
主な論点(案)
○ 特定領域に係る臨床研究中核病院の役割・機能はどうあるべきか。
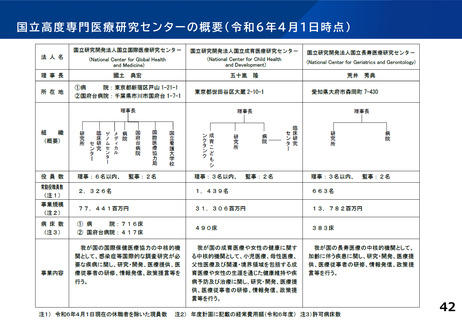
併せて、特定領域の臨床試験への取組として、国立高度専門医療研究センター
(NC)の役割を踏まえ、特定領域に係る臨床研究中核病院の位置づけを
どう考えるか。
10
課
題
○ 臨床試験が進みにくい特定領域(難病・希少疾病、小児疾患等)における研究を推
進するための取組として、特定領域型の臨床研究中核病院を位置づけたが、承認
実績はない。
主な論点(案)
○ 特定領域に係る臨床研究中核病院の役割・機能はどうあるべきか。
併せて、特定領域の臨床試験への取組として、国立高度専門医療研究センター
(NC)の役割を踏まえ、特定領域に係る臨床研究中核病院の位置づけを
どう考えるか。
10