よむ、つかう、まなぶ。
資料1:臨床研究中核病院の承認要件見直しについて (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議
中間とりまとめ(抜粋)
■創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議
中間とりまとめ
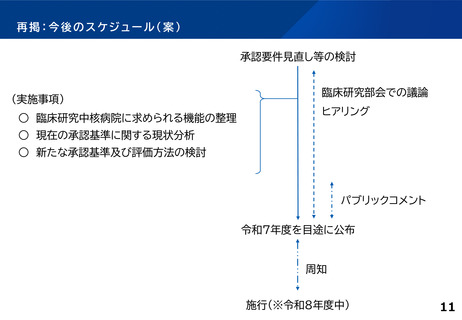
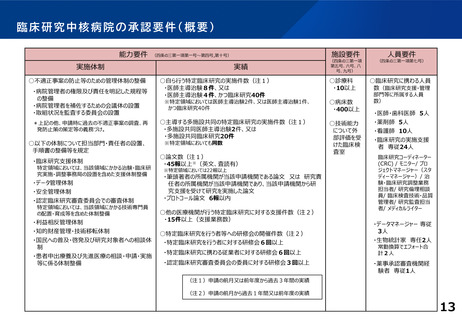
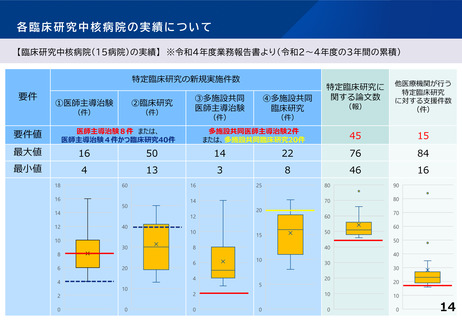
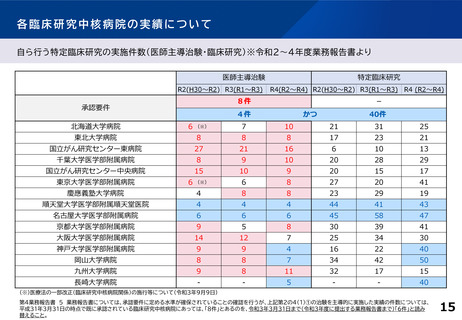
○ 臨床研究中核病院の承認要件の見直し
臨床研究中核病院の承認要件や更新要件について、創薬への貢献度を現行よりも評価する。例え
ば、医薬品等の承認実績への貢献度、企業治験を含めた 国際共同治験や大規模治験の支援・実施に
係る実績等についても新たに評価する。複数年にまたがる評価軸も設ける。また、国際競争力が高く、
優れた(症患特異的な)臨床開発力を有する臨床研究中核病院の区分新設を検討する。
○ 国際共同治験・臨床試験の推進
日本国内に開発拠点を有さない海外のスタートアップや製薬企業から国内での治験・臨床試験の
実施について相談を受け、支援を行うワンストップサービス窓口の設置を行う。ワンストップサービ
スを担う組織は、臨床研究中核病院や国立高度専門医療研究センター(ナショナルセンター)等によ
る国内での治験・臨床試験の実施を調整するとともに、欧米を中心とした海外の製薬企業、有力ス
タートアップに対して、日本での治験・臨床試験の実施に向けて、各種支援内容について紹介し、国
内での治験等の実施を誘致する機能も担う。
○ 国内外の臨床試験ネットワークの強化
国際共同治験・臨床試験を推進するため、アジアを中心とした治験・臨床試験ネットワークの強化を
行うとともに、国内での FIH 試験を含む治験・臨床試験のネットワークを強化するべく、臨床研究中
核病院、ナショナルセンター、独立行政法人国立病院機構(NHO)等の間での知見の共有、人材交流、
共同治験・臨床試験の実施等の連携強化を図る。
38
中間とりまとめ(抜粋)
■創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議
中間とりまとめ
○ 臨床研究中核病院の承認要件の見直し
臨床研究中核病院の承認要件や更新要件について、創薬への貢献度を現行よりも評価する。例え
ば、医薬品等の承認実績への貢献度、企業治験を含めた 国際共同治験や大規模治験の支援・実施に
係る実績等についても新たに評価する。複数年にまたがる評価軸も設ける。また、国際競争力が高く、
優れた(症患特異的な)臨床開発力を有する臨床研究中核病院の区分新設を検討する。
○ 国際共同治験・臨床試験の推進
日本国内に開発拠点を有さない海外のスタートアップや製薬企業から国内での治験・臨床試験の
実施について相談を受け、支援を行うワンストップサービス窓口の設置を行う。ワンストップサービ
スを担う組織は、臨床研究中核病院や国立高度専門医療研究センター(ナショナルセンター)等によ
る国内での治験・臨床試験の実施を調整するとともに、欧米を中心とした海外の製薬企業、有力ス
タートアップに対して、日本での治験・臨床試験の実施に向けて、各種支援内容について紹介し、国
内での治験等の実施を誘致する機能も担う。
○ 国内外の臨床試験ネットワークの強化
国際共同治験・臨床試験を推進するため、アジアを中心とした治験・臨床試験ネットワークの強化を
行うとともに、国内での FIH 試験を含む治験・臨床試験のネットワークを強化するべく、臨床研究中
核病院、ナショナルセンター、独立行政法人国立病院機構(NHO)等の間での知見の共有、人材交流、
共同治験・臨床試験の実施等の連携強化を図る。
38