よむ、つかう、まなぶ。
資料1:臨床研究中核病院の承認要件見直しについて (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
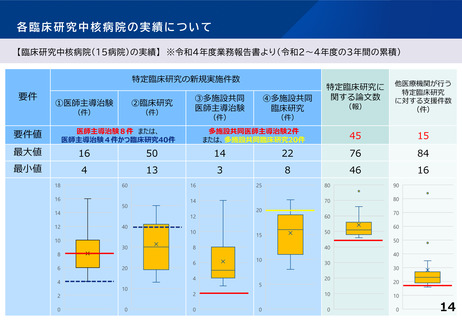
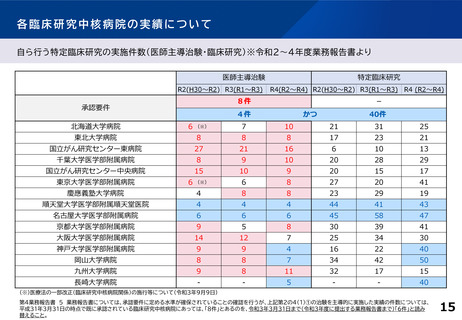
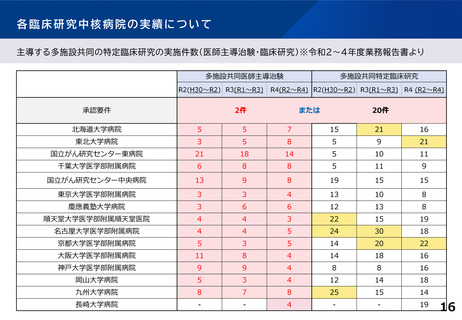
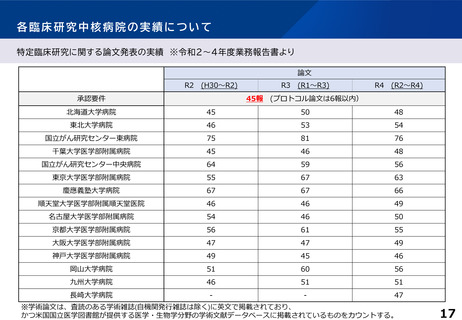
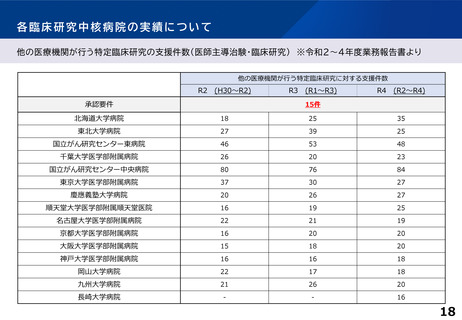
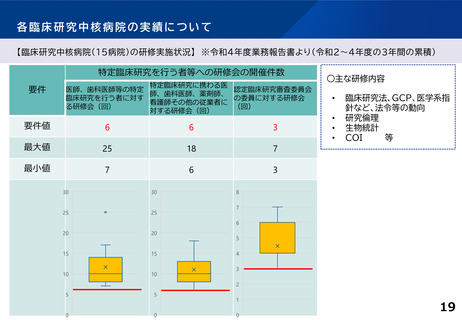
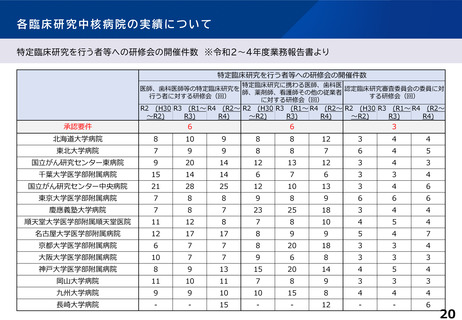
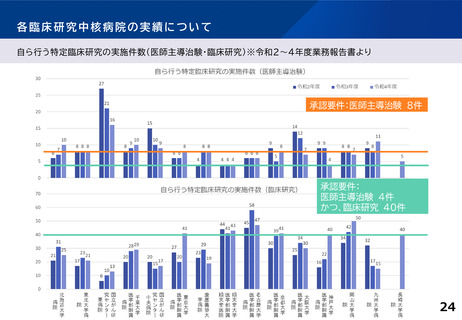
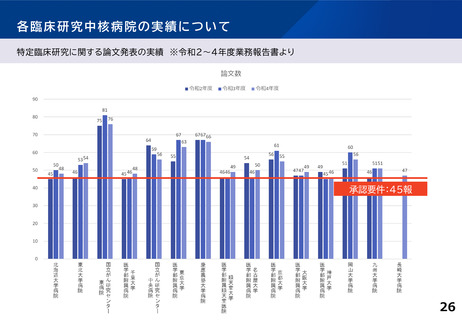
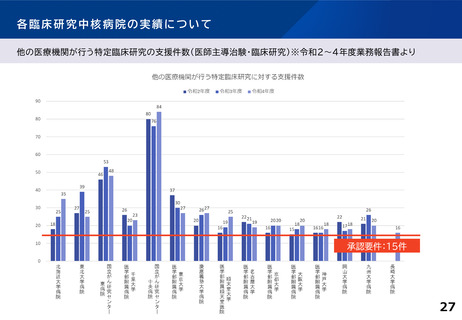
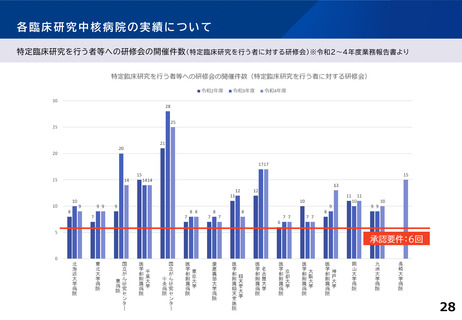
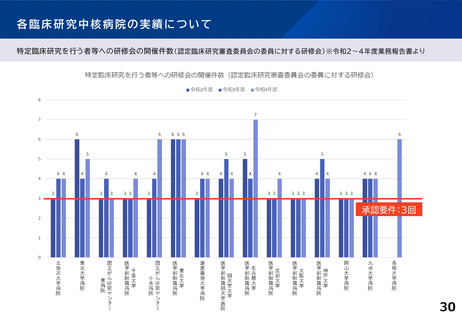
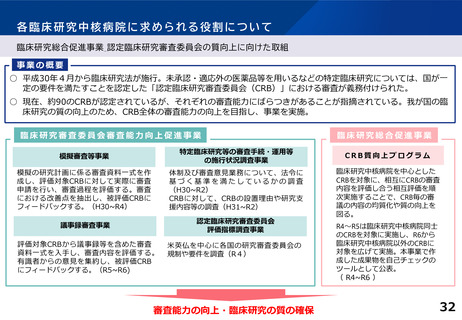
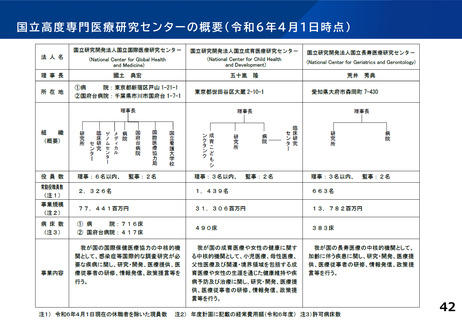
各臨床研究中核病院の実績について
主導する多施設共同の特定臨床研究の実施件数(医師主導治験・臨床研究)※令和2~4年度業務報告書より
多施設共同医師主導治験
R2(H30~R2) R3(R1~R3)
承認要件
多施設共同特定臨床研究
R4(R2~R4) R2(H30~R2) R3(R1~R3) R4 (R2~R4)
2件
または
20件
北海道大学病院
5
5
7
15
21
16
東北大学病院
3
5
8
5
9
21
国立がん研究センター東病院
21
18
14
5
10
11
千葉大学医学部附属病院
6
8
8
5
11
9
国立がん研究センター中央病院
13
9
8
19
15
15
東京大学医学部附属病院
3
3
4
13
10
8
慶應義塾大学病院
3
6
6
12
13
8
順天堂大学医学部附属順天堂医院
4
4
3
22
15
19
名古屋大学医学部附属病院
4
4
5
24
30
18
京都大学医学部附属病院
5
3
5
14
20
22
大阪大学医学部附属病院
11
8
4
14
18
16
神戸大学医学部附属病院
9
9
4
8
8
16
岡山大学病院
5
3
4
12
14
18
九州大学病院
8
7
8
25
15
14
長崎大学病院
-
-
4
-
-
19
16
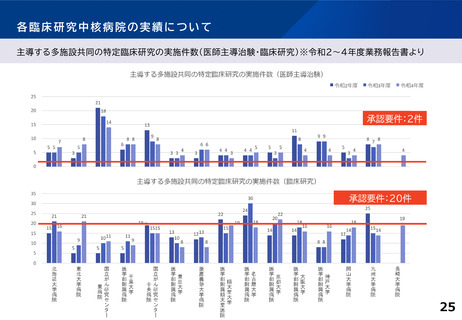
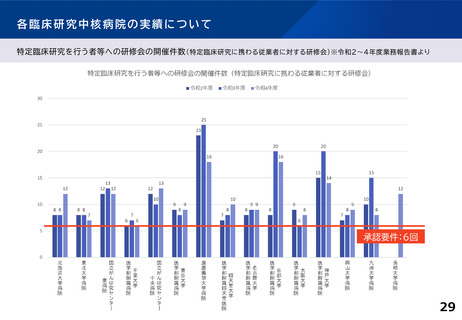
主導する多施設共同の特定臨床研究の実施件数(医師主導治験・臨床研究)※令和2~4年度業務報告書より
多施設共同医師主導治験
R2(H30~R2) R3(R1~R3)
承認要件
多施設共同特定臨床研究
R4(R2~R4) R2(H30~R2) R3(R1~R3) R4 (R2~R4)
2件
または
20件
北海道大学病院
5
5
7
15
21
16
東北大学病院
3
5
8
5
9
21
国立がん研究センター東病院
21
18
14
5
10
11
千葉大学医学部附属病院
6
8
8
5
11
9
国立がん研究センター中央病院
13
9
8
19
15
15
東京大学医学部附属病院
3
3
4
13
10
8
慶應義塾大学病院
3
6
6
12
13
8
順天堂大学医学部附属順天堂医院
4
4
3
22
15
19
名古屋大学医学部附属病院
4
4
5
24
30
18
京都大学医学部附属病院
5
3
5
14
20
22
大阪大学医学部附属病院
11
8
4
14
18
16
神戸大学医学部附属病院
9
9
4
8
8
16
岡山大学病院
5
3
4
12
14
18
九州大学病院
8
7
8
25
15
14
長崎大学病院
-
-
4
-
-
19
16