よむ、つかう、まなぶ。
資料1:臨床研究中核病院の承認要件見直しについて (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
「臨床研究・治験の推進に関する今後の方向性について 2019年版とりまとめ
(2019年12月6日) 」における議論③
「特定領域」臨床研究中核病院について
臨床研究が進みにくい領域における研究を推進するため、
2019年当時、「特定疾病領域(難病・希少疾病、小児疾患、新興・再興感染症)に係
る臨床研究を主として行う申請機関」に関し記載されている要件について、特定領
域の臨床研究を主として実施する臨床研究中核病院として位置づけるものとし、
実績については据え置きとした。
特定領域(小児疾患、難病・希少疾病等)に係る臨床試験を主として行う申請機関について
は、いずれかを満たすこと。
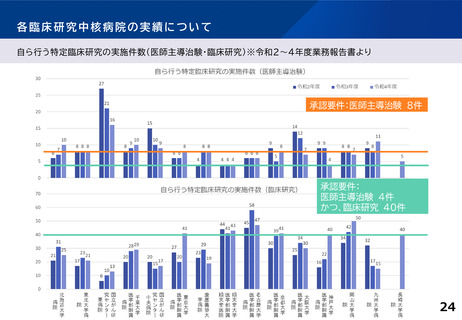
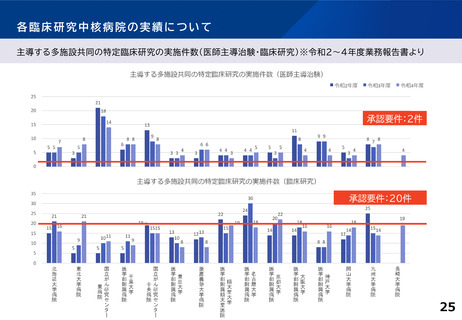
〇医師主導治験2件以上
ないしは 医師主導治験1件+臨床研究40件以上
5
(2019年12月6日) 」における議論③
「特定領域」臨床研究中核病院について
臨床研究が進みにくい領域における研究を推進するため、
2019年当時、「特定疾病領域(難病・希少疾病、小児疾患、新興・再興感染症)に係
る臨床研究を主として行う申請機関」に関し記載されている要件について、特定領
域の臨床研究を主として実施する臨床研究中核病院として位置づけるものとし、
実績については据え置きとした。
特定領域(小児疾患、難病・希少疾病等)に係る臨床試験を主として行う申請機関について
は、いずれかを満たすこと。
〇医師主導治験2件以上
ないしは 医師主導治験1件+臨床研究40件以上
5