よむ、つかう、まなぶ。
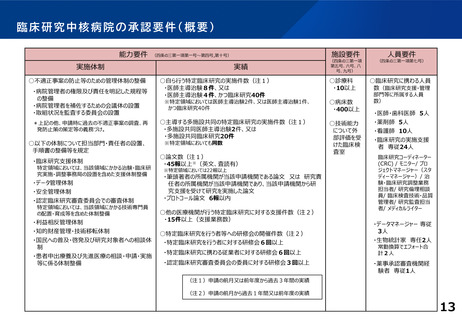
資料1:臨床研究中核病院の承認要件見直しについて (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
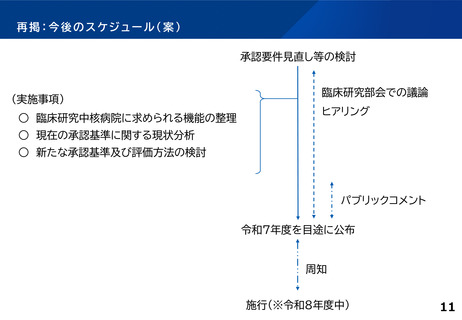
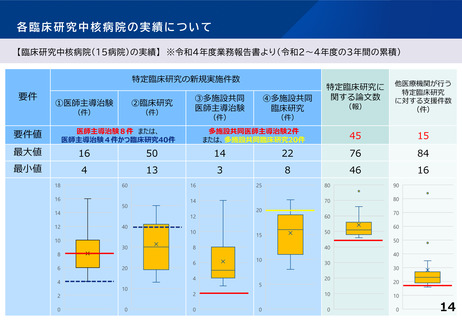
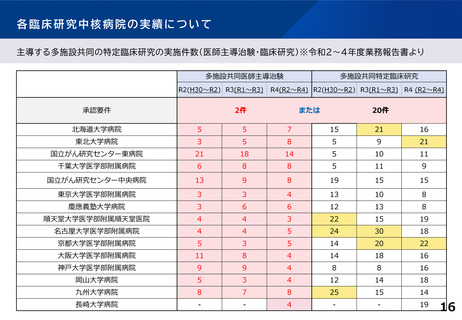
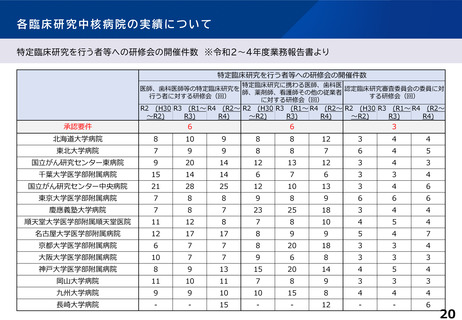
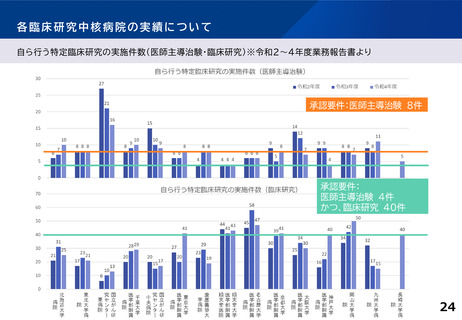
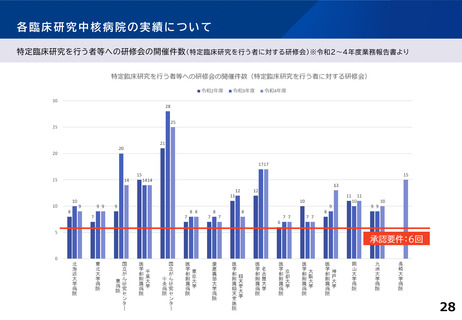
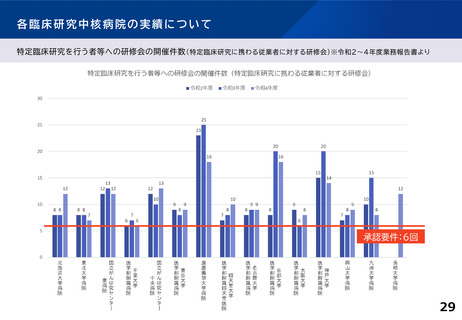
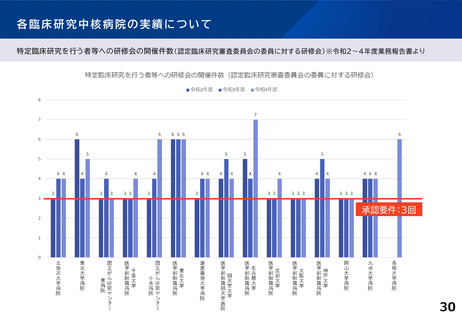
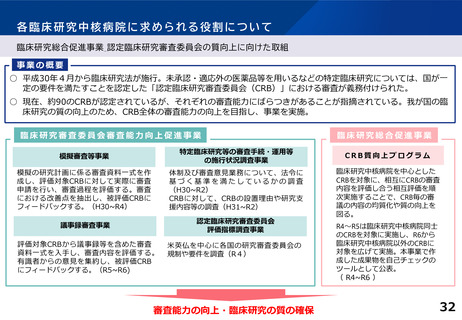
各臨床研究中核病院の実績について
【臨床研究中核病院(15病院)の実績】 ※令和4年度業務報告書より(令和2~4年度の3年間の累積)
特定臨床研究の新規実施件数
要件
要件値
①医師主導治験
②臨床研究
(件)
(件)
医師主導治験8件 または、
医師主導治験4件かつ臨床研究40件
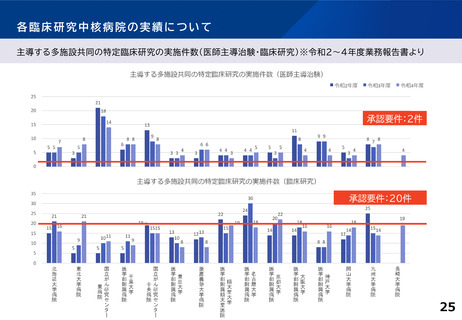
③多施設共同
医師主導治験
④多施設共同
臨床研究
(件)
(件)
多施設共同医師主導治験2件
または、多施設共同臨床研究20件
(報)
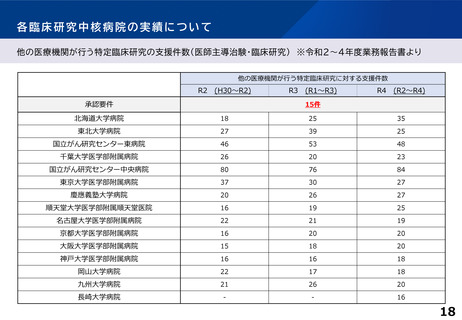
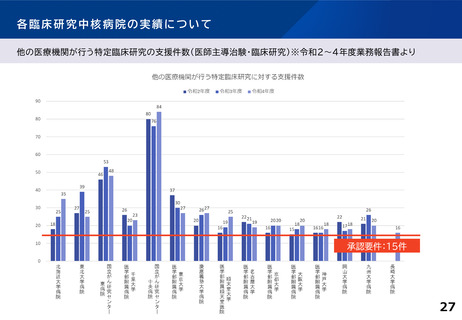
他医療機関が行う
特定臨床研究
に対する支援件数
(件)
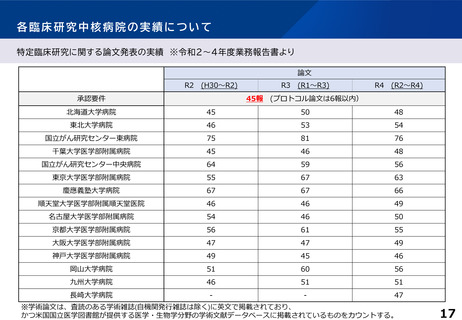
45
15
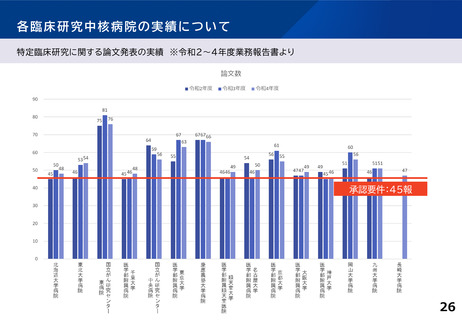
特定臨床研究に
関する論文数
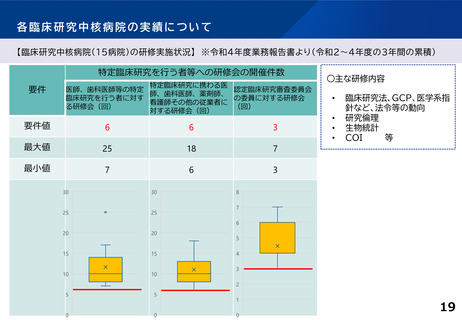
最大値
16
50
14
22
76
84
最小値
4
13
3
8
46
16
14
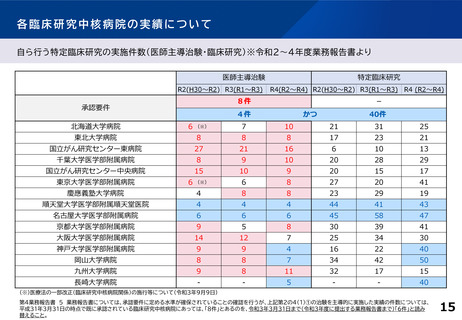
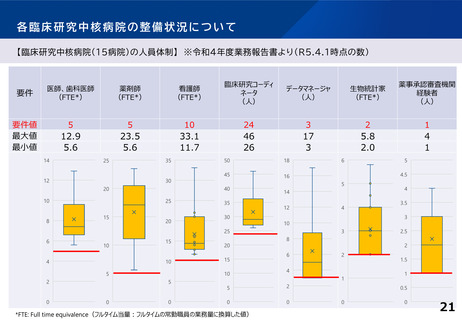
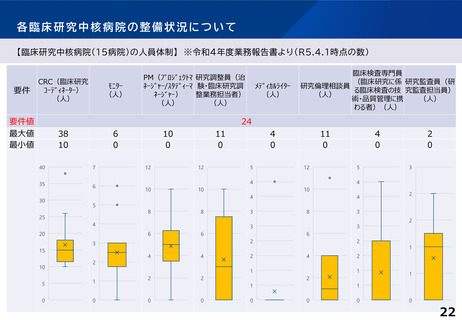
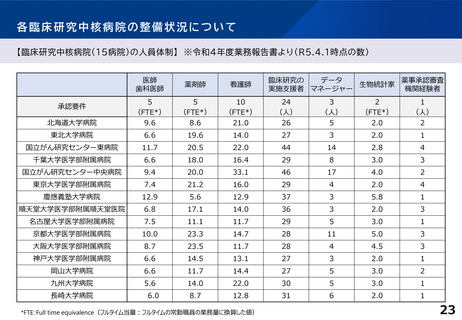
【臨床研究中核病院(15病院)の実績】 ※令和4年度業務報告書より(令和2~4年度の3年間の累積)
特定臨床研究の新規実施件数
要件
要件値
①医師主導治験
②臨床研究
(件)
(件)
医師主導治験8件 または、
医師主導治験4件かつ臨床研究40件
③多施設共同
医師主導治験
④多施設共同
臨床研究
(件)
(件)
多施設共同医師主導治験2件
または、多施設共同臨床研究20件
(報)
他医療機関が行う
特定臨床研究
に対する支援件数
(件)
45
15
特定臨床研究に
関する論文数
最大値
16
50
14
22
76
84
最小値
4
13
3
8
46
16
14