よむ、つかう、まなぶ。
資料1:臨床研究中核病院の承認要件見直しについて (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
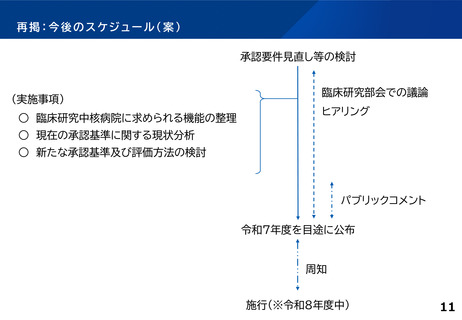
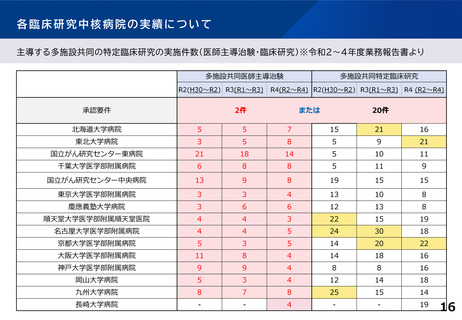
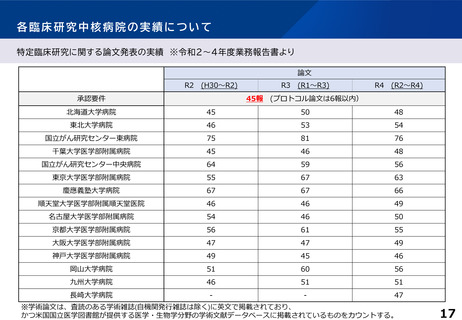
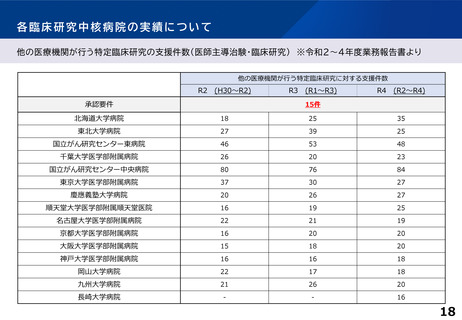
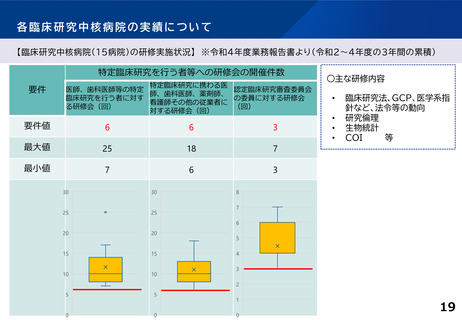
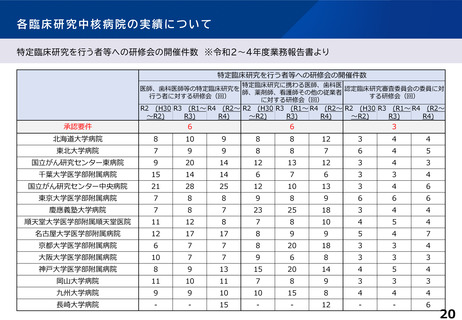
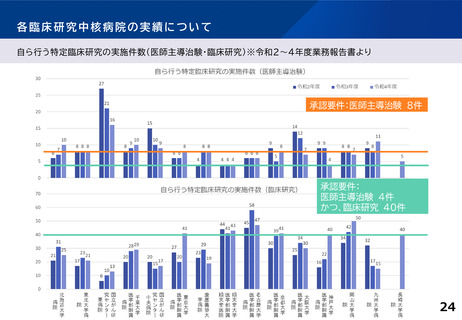
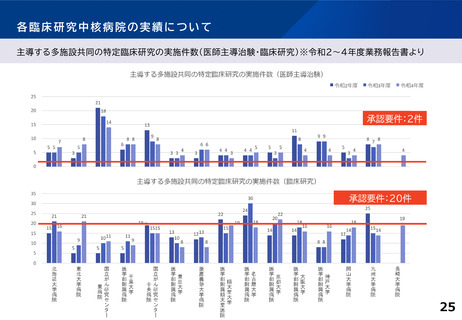
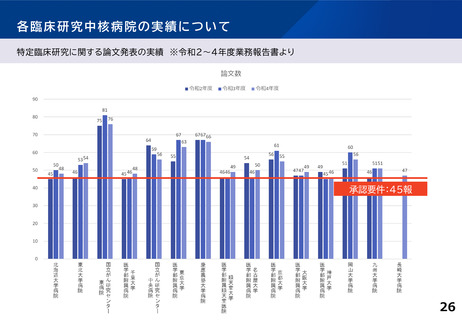
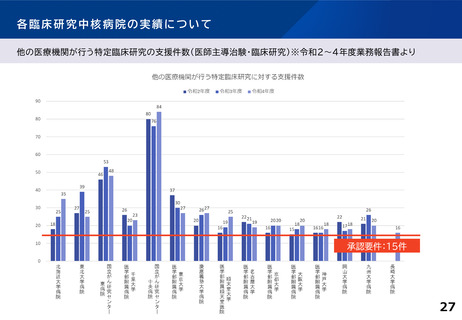
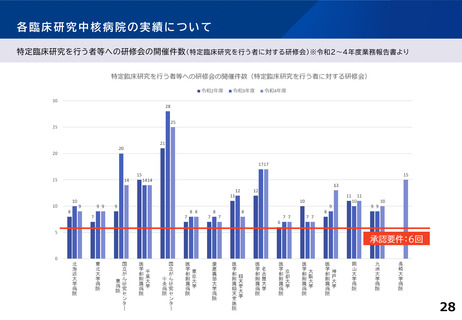
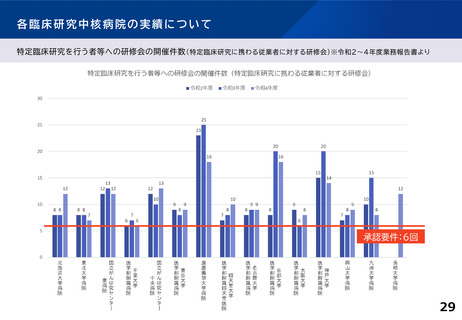
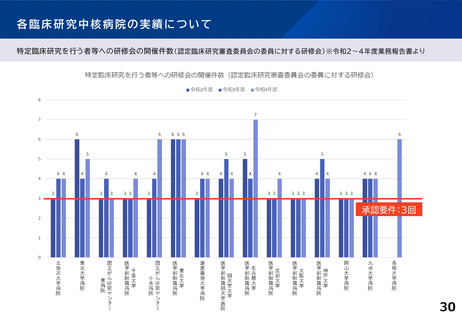
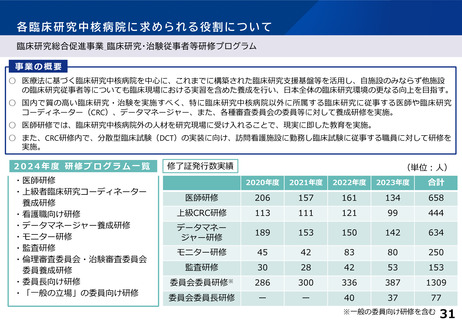
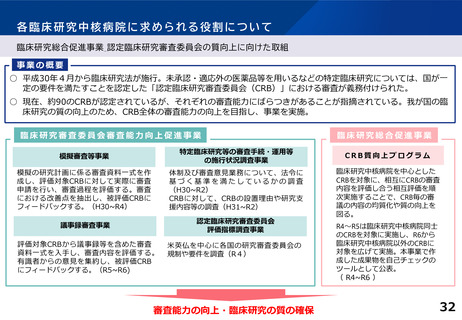
各臨床研究中核病院に求められる役割について
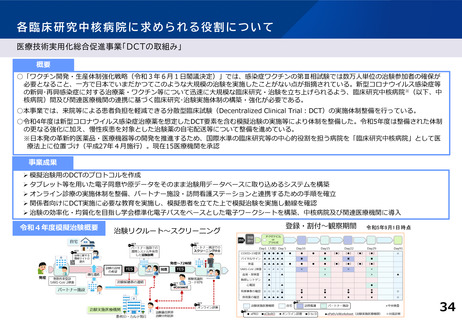
医療技術実用化総合促進事業「DCTの取組み」
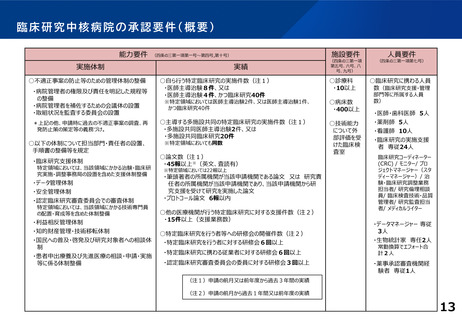
概要
○「ワクチン開発・生産体制強化戦略(令和3年6月1日閣議決定)」では、感染症ワクチンの第Ⅲ相試験では数万人単位の治験参加者の確保が
必要となること、一方で日本でいまだかつてこのような大規模の治験を実施したことがない点が指摘されている。新型コロナウイルス感染症等
の新興・再興感染症に対する治療薬・ワクチン等について迅速に大規模な臨床研究・治験を立ち上げられるよう、臨床研究中核病院※(以下、中
核病院)間及び関連医療機関の連携に基づく臨床研究・治験実施体制の構築・強化が必要である。
○本事業では、来院等による患者負担を軽減できる分散型臨床試験(Decentralized Clinical Trial:DCT)の実施体制整備を行っている。
○令和4年度は新型コロナウイルス感染症治療薬を想定したDCT要素を含む模擬治験の実施等により体制を整備した。令和5年度は整備された体制
の更なる強化に加え、慢性疾患を対象とした治験薬の自宅配送等について整備を進めている。
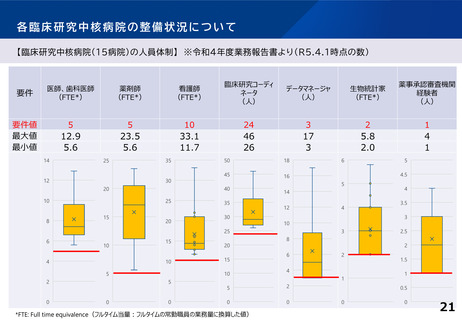
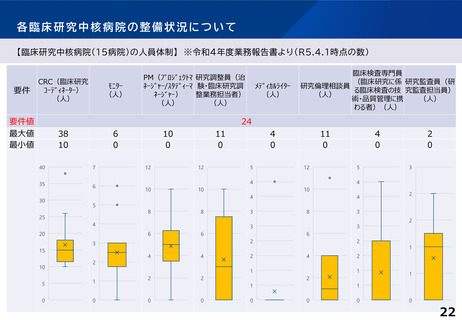
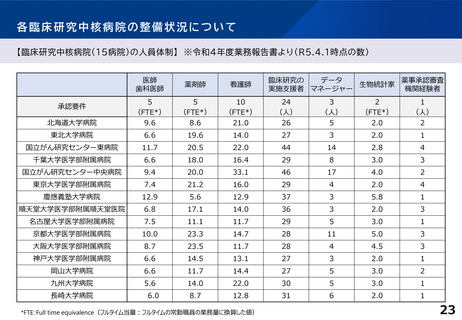
※日本発の革新的医薬品・医療機器等の開発を推進するため、国際水準の臨床研究等の中心的役割を担う病院を「臨床研究中核病院」として医
療法上に位置づけ(平成27年4月施行)。現在15医療機関を承認
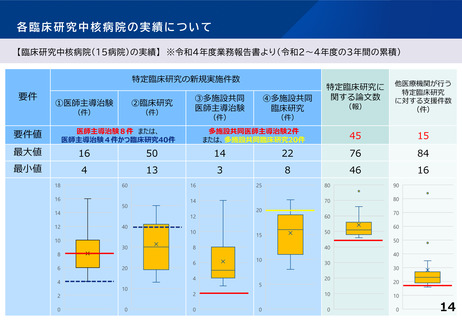
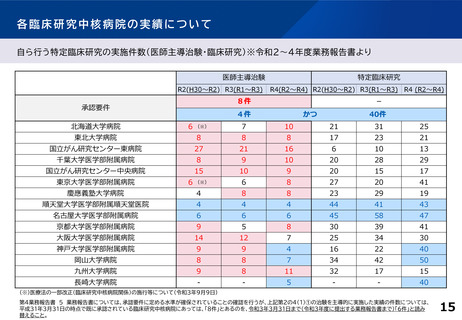
事業成果
➢ 模擬治験用のDCTのプロトコルを作成
➢ タブレット等を用いた電子同意や原データをそのまま治験用データベースに取り込めるシステムを構築
➢ オンライン診療の実施体制を整備、パートナー施設・訪問看護ステーションと連携するための手順を確立
➢ 関係者向けにDCT実施に必要な教育を実施し、模擬患者を立てた上で模擬治験を実施し動線を確認
➢ 治験の効率化・均質化を目指し学会標準化電子パスをベースとした電子ワークシートを構築、中核病院及び関連医療機関に導入
令和4年度模擬治験概要
治験リクルート~スクリーニング
登録・割付~観察期間
令和5年9月1日時点
34
医療技術実用化総合促進事業「DCTの取組み」
概要
○「ワクチン開発・生産体制強化戦略(令和3年6月1日閣議決定)」では、感染症ワクチンの第Ⅲ相試験では数万人単位の治験参加者の確保が
必要となること、一方で日本でいまだかつてこのような大規模の治験を実施したことがない点が指摘されている。新型コロナウイルス感染症等
の新興・再興感染症に対する治療薬・ワクチン等について迅速に大規模な臨床研究・治験を立ち上げられるよう、臨床研究中核病院※(以下、中
核病院)間及び関連医療機関の連携に基づく臨床研究・治験実施体制の構築・強化が必要である。
○本事業では、来院等による患者負担を軽減できる分散型臨床試験(Decentralized Clinical Trial:DCT)の実施体制整備を行っている。
○令和4年度は新型コロナウイルス感染症治療薬を想定したDCT要素を含む模擬治験の実施等により体制を整備した。令和5年度は整備された体制
の更なる強化に加え、慢性疾患を対象とした治験薬の自宅配送等について整備を進めている。
※日本発の革新的医薬品・医療機器等の開発を推進するため、国際水準の臨床研究等の中心的役割を担う病院を「臨床研究中核病院」として医
療法上に位置づけ(平成27年4月施行)。現在15医療機関を承認
事業成果
➢ 模擬治験用のDCTのプロトコルを作成
➢ タブレット等を用いた電子同意や原データをそのまま治験用データベースに取り込めるシステムを構築
➢ オンライン診療の実施体制を整備、パートナー施設・訪問看護ステーションと連携するための手順を確立
➢ 関係者向けにDCT実施に必要な教育を実施し、模擬患者を立てた上で模擬治験を実施し動線を確認
➢ 治験の効率化・均質化を目指し学会標準化電子パスをベースとした電子ワークシートを構築、中核病院及び関連医療機関に導入
令和4年度模擬治験概要
治験リクルート~スクリーニング
登録・割付~観察期間
令和5年9月1日時点
34