よむ、つかう、まなぶ。
資料1:臨床研究中核病院の承認要件見直しについて (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
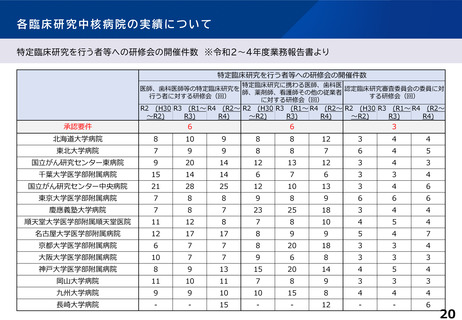
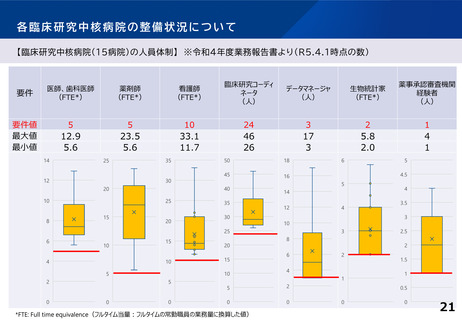
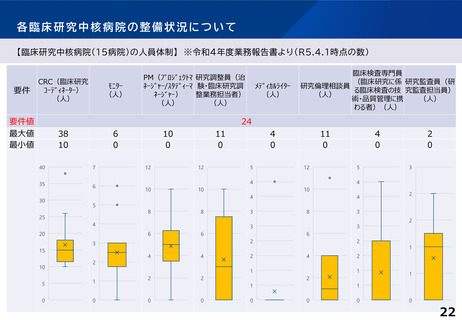
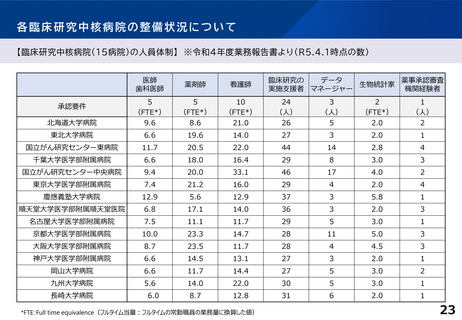
臨床研究中核病院の承認要件に関する課題と論点(案)②
課
題
○ 創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議中間と
りまとめにおいて、「臨床研究中核病院の承認要件の見直し」として、「国際競争力
が高く、優れた(症患特異的な)臨床開発力を有する臨床研究中核病院の区分新設
を検討する」とされている。
主な論点(案)
○ 国際競争力が高く、優れた(症患特異的な)臨床開発力を有する臨床研究中核病
院の役割・機能はどうあるべきか。
9
課
題
○ 創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議中間と
りまとめにおいて、「臨床研究中核病院の承認要件の見直し」として、「国際競争力
が高く、優れた(症患特異的な)臨床開発力を有する臨床研究中核病院の区分新設
を検討する」とされている。
主な論点(案)
○ 国際競争力が高く、優れた(症患特異的な)臨床開発力を有する臨床研究中核病
院の役割・機能はどうあるべきか。
9