よむ、つかう、まなぶ。
資料1:臨床研究中核病院の承認要件見直しについて (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
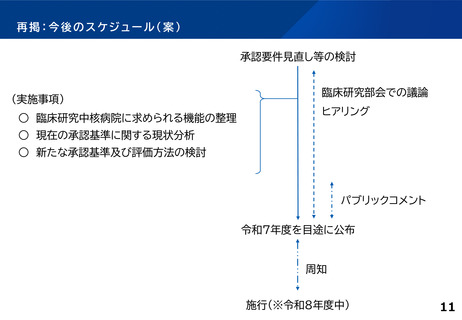
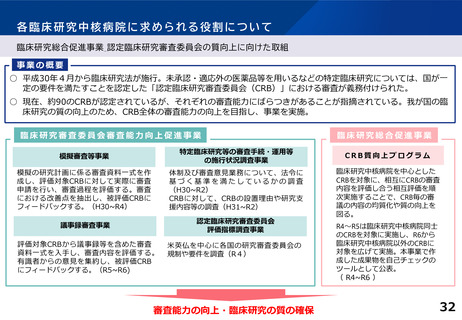
「臨床研究・治験の推進に関する今後の方向性について 2019年版とりまとめ
(2019年12月6日) 」における議論②
2019年当時の見直しの検討時に採用が見送られた事項について
具体的な指標が定まらない以下のような項目については、今後の見直しにおける要件化を見据え、各拠点における活動状況
の適切な把握を行うものとして、定期的な報告を求めることとした。
•
•
•
診療の最適化に係る研究の実施状況、論文状況
薬事承認等の研究成果の実用化に結び付いた事例
リアルワールドデータ(Real world data、以下RWD(※))の研究利活用のための体制整備や利活用事例
※RWD・・・日常診療で得られる医療データのこと。電子カルテ情報やレセプトデータなどが含まれる。
「臨床研究・治験の推進に関する今後の方向性について 2019年版とりまとめ(2019年12月6日) 」
(別添1)臨床研究中核病院の承認要件の見直しについて
○ その他
2. 臨床研究中核病院については、。
我が国の国際水準の臨床研究や医師主導治験の中心的役割を担う拠点であることから、承認要件として規定されている事項の他に、
以下の事項についても真摯な取組みを求める
(1) 病院管理者は病院内の各部門からの独立性を確保する等の適切なガバナンス体制を構築し、研究の実施及び支援においては
部門間の連携を行わせること。
(2) 医療情報の標準化、臨床研究や治験における電磁化手法の活用、企業治験の円滑な実施に係る手続、体制の整備に必要な措置
についても積極的に行っていくこと。
(3) 革新的な医薬品・医療機器等の開発の推進のため、必要に応じ、医工連携等を始めとした医学分野以外の研究分野との積極的な
連携を行うこと。
(4) First-in-Human(FIH)試験が実施できる体制を確保すること。また、診療ガイドラインの策定に資する臨床研究及び革新的な
医薬品・医療機器等の開発に必要となる企業治験の実施についても積極的に行っていくこと。
(5) 臨床研究に携わる者に対し、系統的な研修プログラムを策定し、高度な臨床研究人材の育成に努めること。その際、臨床研究に関
する国内の各種講習会の受講を積極的に勧奨するとともに、国際水準の臨床研究の実施のために、国際的な認定資格の取得等
を積極的に勧奨すること。
(6) 臨床研究中核病院の役割や取組み等について、患者・国民及びその他の医療機関等へ周知を図ること。また、患者・国民の臨床研
究・治験に関する理解の向上や参画に必要な取組みについても積極的に行っていくこと。
4
(2019年12月6日) 」における議論②
2019年当時の見直しの検討時に採用が見送られた事項について
具体的な指標が定まらない以下のような項目については、今後の見直しにおける要件化を見据え、各拠点における活動状況
の適切な把握を行うものとして、定期的な報告を求めることとした。
•
•
•
診療の最適化に係る研究の実施状況、論文状況
薬事承認等の研究成果の実用化に結び付いた事例
リアルワールドデータ(Real world data、以下RWD(※))の研究利活用のための体制整備や利活用事例
※RWD・・・日常診療で得られる医療データのこと。電子カルテ情報やレセプトデータなどが含まれる。
「臨床研究・治験の推進に関する今後の方向性について 2019年版とりまとめ(2019年12月6日) 」
(別添1)臨床研究中核病院の承認要件の見直しについて
○ その他
2. 臨床研究中核病院については、。
我が国の国際水準の臨床研究や医師主導治験の中心的役割を担う拠点であることから、承認要件として規定されている事項の他に、
以下の事項についても真摯な取組みを求める
(1) 病院管理者は病院内の各部門からの独立性を確保する等の適切なガバナンス体制を構築し、研究の実施及び支援においては
部門間の連携を行わせること。
(2) 医療情報の標準化、臨床研究や治験における電磁化手法の活用、企業治験の円滑な実施に係る手続、体制の整備に必要な措置
についても積極的に行っていくこと。
(3) 革新的な医薬品・医療機器等の開発の推進のため、必要に応じ、医工連携等を始めとした医学分野以外の研究分野との積極的な
連携を行うこと。
(4) First-in-Human(FIH)試験が実施できる体制を確保すること。また、診療ガイドラインの策定に資する臨床研究及び革新的な
医薬品・医療機器等の開発に必要となる企業治験の実施についても積極的に行っていくこと。
(5) 臨床研究に携わる者に対し、系統的な研修プログラムを策定し、高度な臨床研究人材の育成に努めること。その際、臨床研究に関
する国内の各種講習会の受講を積極的に勧奨するとともに、国際水準の臨床研究の実施のために、国際的な認定資格の取得等
を積極的に勧奨すること。
(6) 臨床研究中核病院の役割や取組み等について、患者・国民及びその他の医療機関等へ周知を図ること。また、患者・国民の臨床研
究・治験に関する理解の向上や参画に必要な取組みについても積極的に行っていくこと。
4