よむ、つかう、まなぶ。
資料1:臨床研究中核病院の承認要件見直しについて (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44426.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第37回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
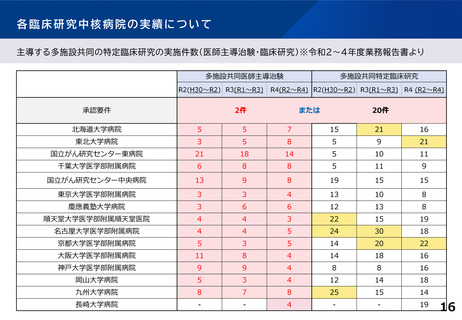
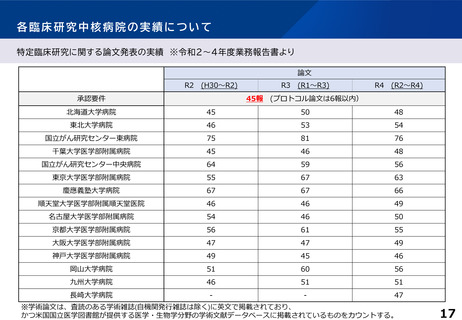
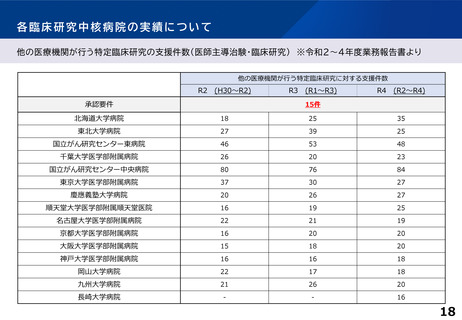
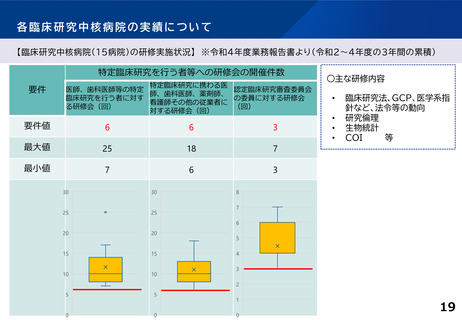
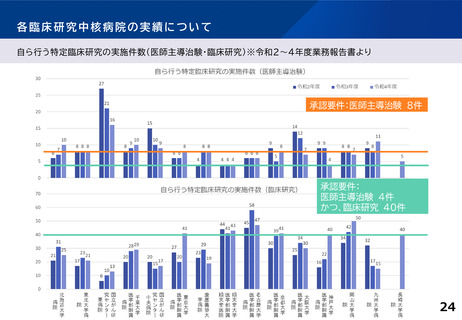
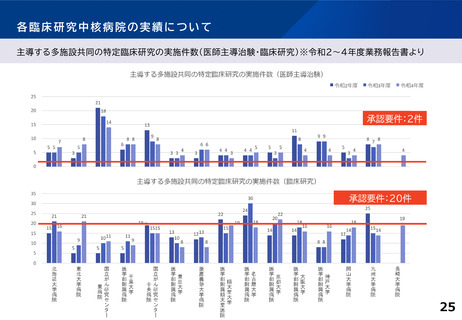
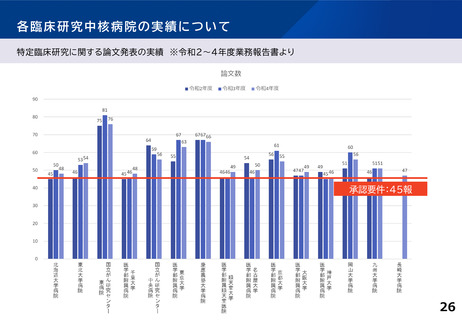
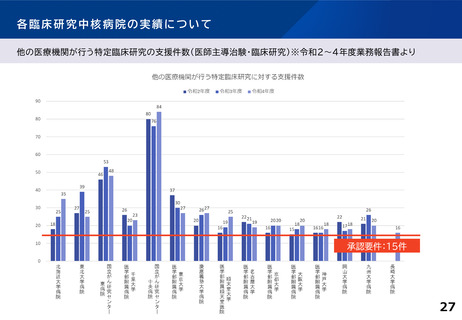
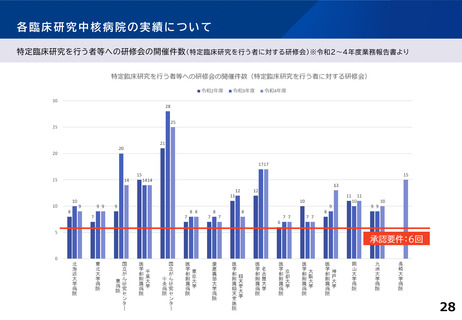
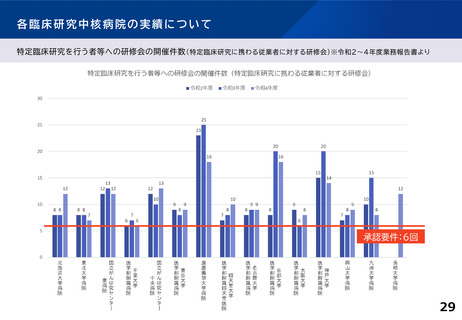
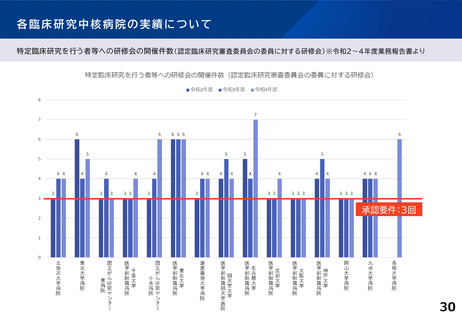
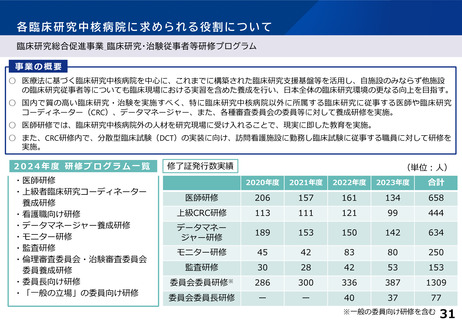
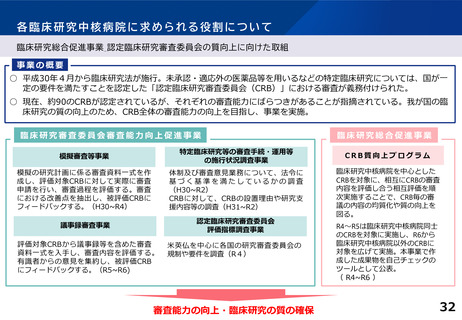
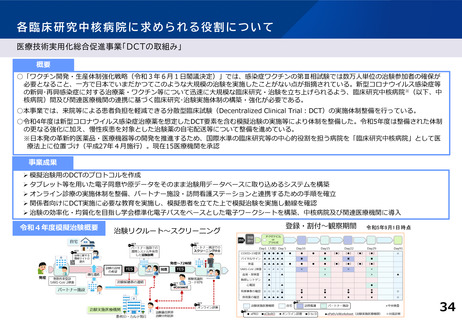
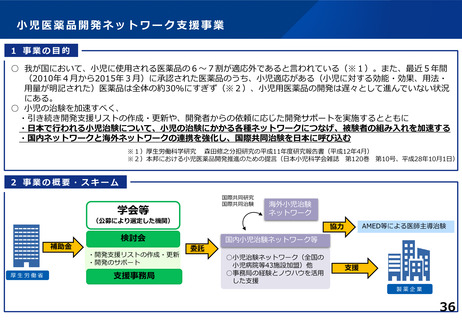
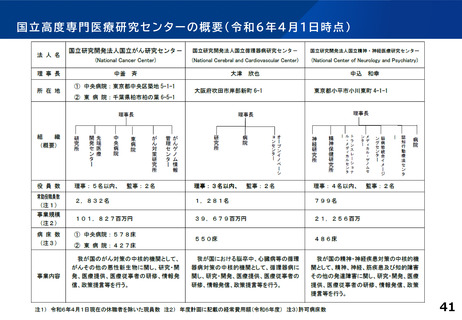
各臨床研究中核病院に求められる役割について
医療技術実用化総合促進事業
事業の目的
• 医療法に基づき厚生労働大臣に承認される臨床研究中核病院は、臨床研究・治験を自ら積極的に実施する高い能力を
持つのみならず、他の医療機関が臨床研究・治験を行う際の多角的な支援を行うものとして、日本全体の研究開発基
盤としての役割が求められている。また、革新的医療技術創出拠点として、文部科学大臣が認定した橋渡し研究支援
機関と連携することにより、基礎研究から実用化まで一貫して支援する体制が整備されている。
• 臨床研究中核病院がその臨床研究支援・実施基盤及びネットワーク基盤を利活用して日本全体の研究開発基盤を強化
するとともに、日本発の革新的医療シーズ等の実用化や国際化に繋げる取組みを推進していく。
• 質の高い臨床研究実施のためのノウハウの獲得
• 臨床研究中核病院による研究に際し最適な支援
• 臨床研究中核病院の研究基盤・
支援体制の利活用
• 自施設の研究資源の効率化
研究者
医療機関
臨床研究中核病院を介した
臨床研究の相互協力
医療技術の実用化スキームの
効率化、迅速化、標準化
• 実用化に向けた最適なサポート
• 臨床研究中核病院の研究基盤を
ベンチャー 活用した産学の連携
企業
国際共同臨床研究実施推進プログラム
医療系ベンチャー育成支援プログラム
未承認医薬品等臨床研究安全性確保
支援プログラム
海外対応可能な人材の育成や、国際共同治験を
実施する者に対する様々な支援(研究計画の立
案・作成や企業折衝、コンサルテーション等)
を実施
国際共同臨床研究を担う人材育成を目的とした
欧米等の先端的な臨床研究を実施する医療機関
等への人材派遣を実施
平成29年度に全ての臨床研究中核病院に設置
されたベンチャー支援部門を利活用し、アカデ
ミアに対しては、企業導出戦略等の立案を、企
業に対しては、中核病院の資源を生かした共同
研究等の提案を行える産学連携の中心となるよ
うな人材の配備と育成を実施
従来のCRCやDM等の雇用や、海外からの関連
情報収集等に加え、自施設内の診療情報の標準
化及びその運用体制整備、ノウハウの蓄積を行
い、自施設内で実施される臨床研究の安全性向
上の一層の推進を図るとともに、中核病院同士
の医療情報の連結を進める
33
医療技術実用化総合促進事業
事業の目的
• 医療法に基づき厚生労働大臣に承認される臨床研究中核病院は、臨床研究・治験を自ら積極的に実施する高い能力を
持つのみならず、他の医療機関が臨床研究・治験を行う際の多角的な支援を行うものとして、日本全体の研究開発基
盤としての役割が求められている。また、革新的医療技術創出拠点として、文部科学大臣が認定した橋渡し研究支援
機関と連携することにより、基礎研究から実用化まで一貫して支援する体制が整備されている。
• 臨床研究中核病院がその臨床研究支援・実施基盤及びネットワーク基盤を利活用して日本全体の研究開発基盤を強化
するとともに、日本発の革新的医療シーズ等の実用化や国際化に繋げる取組みを推進していく。
• 質の高い臨床研究実施のためのノウハウの獲得
• 臨床研究中核病院による研究に際し最適な支援
• 臨床研究中核病院の研究基盤・
支援体制の利活用
• 自施設の研究資源の効率化
研究者
医療機関
臨床研究中核病院を介した
臨床研究の相互協力
医療技術の実用化スキームの
効率化、迅速化、標準化
• 実用化に向けた最適なサポート
• 臨床研究中核病院の研究基盤を
ベンチャー 活用した産学の連携
企業
国際共同臨床研究実施推進プログラム
医療系ベンチャー育成支援プログラム
未承認医薬品等臨床研究安全性確保
支援プログラム
海外対応可能な人材の育成や、国際共同治験を
実施する者に対する様々な支援(研究計画の立
案・作成や企業折衝、コンサルテーション等)
を実施
国際共同臨床研究を担う人材育成を目的とした
欧米等の先端的な臨床研究を実施する医療機関
等への人材派遣を実施
平成29年度に全ての臨床研究中核病院に設置
されたベンチャー支援部門を利活用し、アカデ
ミアに対しては、企業導出戦略等の立案を、企
業に対しては、中核病院の資源を生かした共同
研究等の提案を行える産学連携の中心となるよ
うな人材の配備と育成を実施
従来のCRCやDM等の雇用や、海外からの関連
情報収集等に加え、自施設内の診療情報の標準
化及びその運用体制整備、ノウハウの蓄積を行
い、自施設内で実施される臨床研究の安全性向
上の一層の推進を図るとともに、中核病院同士
の医療情報の連結を進める
33