よむ、つかう、まなぶ。
【参考資料】これまでの議論で出された主な意見.pdf (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46170.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第9回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
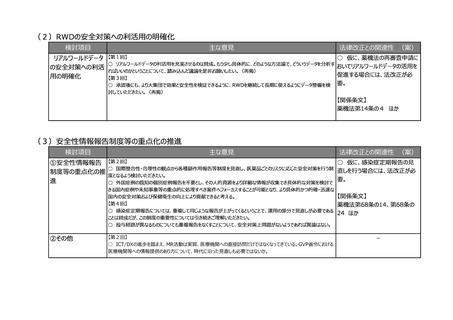
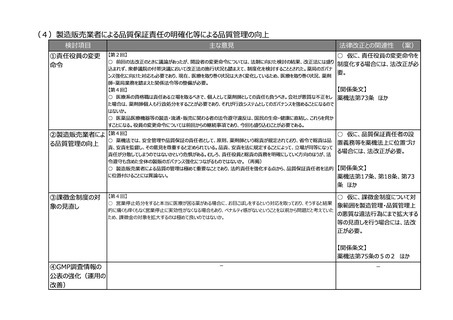
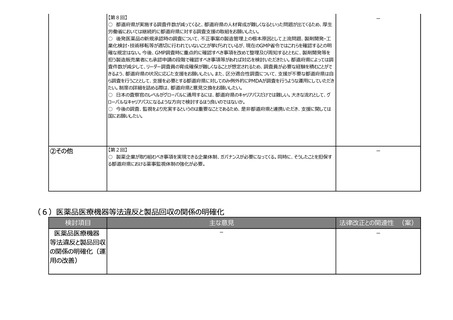
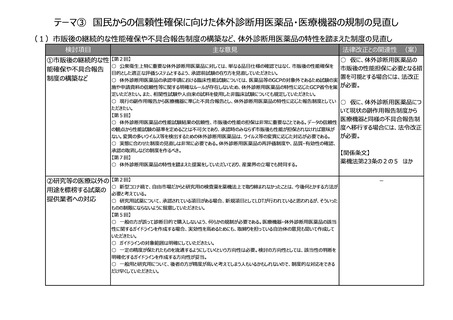
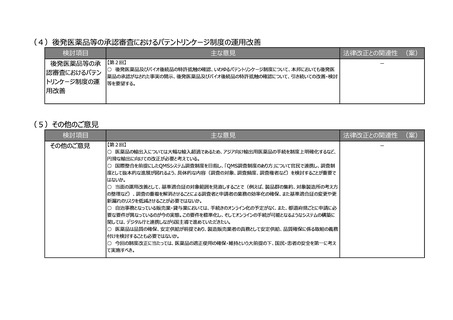
(8)再生医療等製品の特性を踏まえた治療アクセスの改善
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、自家細胞を用いた再生
再生医療等製品 【第2回】
○ 自家細胞加工製品では発生が避けられない規格外品について、患者の治療アクセスを確保するため、法第65条
医療等製品について、一定の要件
の特性を踏まえた治
の5(販売、製造等の禁止)に例外規定を設け、致死的で重篤な疾患あるいは状態にあり、治療選択肢のない患者に
を満たす場合に限って規格外品の
療アクセスの改善
対して医師及び患者本人から要請を受けた場合に限り、治療目的での規格外品の提供を可能とする改正を要望す
販売・授与等を許容する場合に
る。
は、法改正が必要。
【第3回】
○ 規格外品を使っていく道を開くことに対して非常に賛成だが、レジストリのデータの重要性は引き続き重要ということ
で、こちらも整備を進めていきたい。また、規格外品が少なくなればなお良いし、更には再生先進医療や患者申出療養
【関係条文】
の使い道がより拡大することも大事なので、これだけではない形で、再生医療が広く必要な方に普及するような体制を考
薬機法第65条の5 ほか
慮いただきたい。
○ 救済制度や医療行為としての安全確保法との整合性などについて、整理していただきたい。
○ 一様に規格外品を使っていいとするのではなく、患者それぞれの症例や重篤性、状態に合わせて、満たすべき要件
が慎重に考えられていくべき。
○ 例外的な取扱いであるため、本来するべき製造管理の工程が甘くならないような制度設計をすべき。
【第6回】
○ 再生医療は非常に個別性が強く、誰にでも合うものに限ってしまうと使用できる製品がかなり少なくなってしまう特性
がある。不適合が少ないことは大事だが、ある程度トライアル&エラーの余地を残さないと、そもそもの再生医療等製品
の発展性自体が危険にさらされることもあると思うで柔軟に御検討いただきたい。
【第7回】
○ 以前のヒアリング内容を踏まえると、授与に加えて販売も許容するのは実態と違う段階になってしまうのではないか。
-11-
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、自家細胞を用いた再生
再生医療等製品 【第2回】
○ 自家細胞加工製品では発生が避けられない規格外品について、患者の治療アクセスを確保するため、法第65条
医療等製品について、一定の要件
の特性を踏まえた治
の5(販売、製造等の禁止)に例外規定を設け、致死的で重篤な疾患あるいは状態にあり、治療選択肢のない患者に
を満たす場合に限って規格外品の
療アクセスの改善
対して医師及び患者本人から要請を受けた場合に限り、治療目的での規格外品の提供を可能とする改正を要望す
販売・授与等を許容する場合に
る。
は、法改正が必要。
【第3回】
○ 規格外品を使っていく道を開くことに対して非常に賛成だが、レジストリのデータの重要性は引き続き重要ということ
で、こちらも整備を進めていきたい。また、規格外品が少なくなればなお良いし、更には再生先進医療や患者申出療養
【関係条文】
の使い道がより拡大することも大事なので、これだけではない形で、再生医療が広く必要な方に普及するような体制を考
薬機法第65条の5 ほか
慮いただきたい。
○ 救済制度や医療行為としての安全確保法との整合性などについて、整理していただきたい。
○ 一様に規格外品を使っていいとするのではなく、患者それぞれの症例や重篤性、状態に合わせて、満たすべき要件
が慎重に考えられていくべき。
○ 例外的な取扱いであるため、本来するべき製造管理の工程が甘くならないような制度設計をすべき。
【第6回】
○ 再生医療は非常に個別性が強く、誰にでも合うものに限ってしまうと使用できる製品がかなり少なくなってしまう特性
がある。不適合が少ないことは大事だが、ある程度トライアル&エラーの余地を残さないと、そもそもの再生医療等製品
の発展性自体が危険にさらされることもあると思うで柔軟に御検討いただきたい。
【第7回】
○ 以前のヒアリング内容を踏まえると、授与に加えて販売も許容するのは実態と違う段階になってしまうのではないか。
-11-