よむ、つかう、まなぶ。
【参考資料】これまでの議論で出された主な意見.pdf (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46170.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第9回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
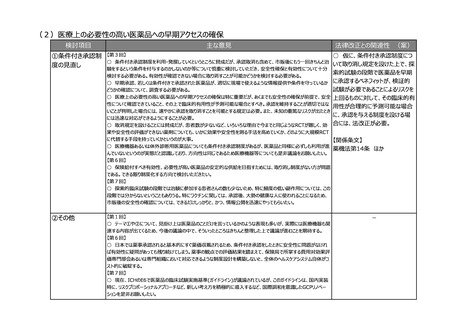
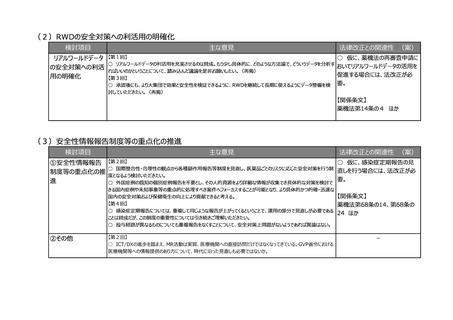
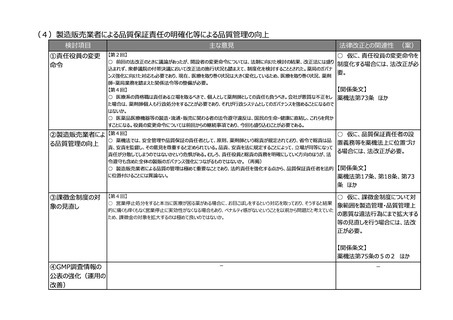
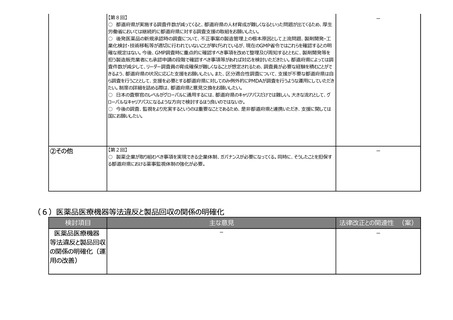
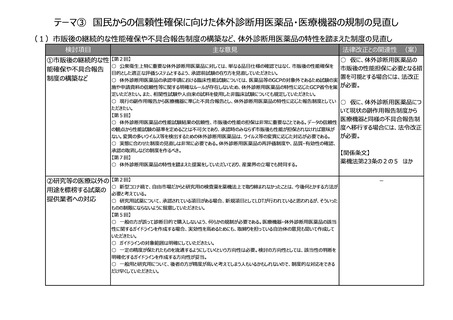
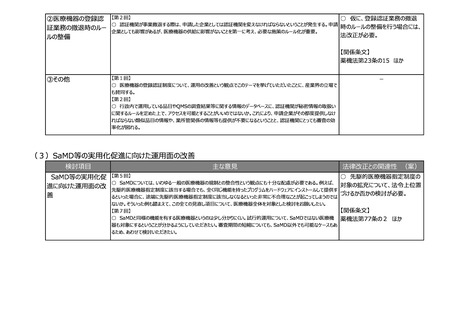
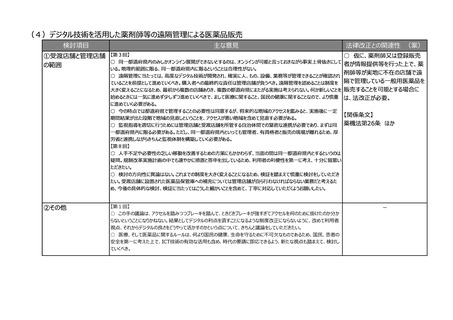
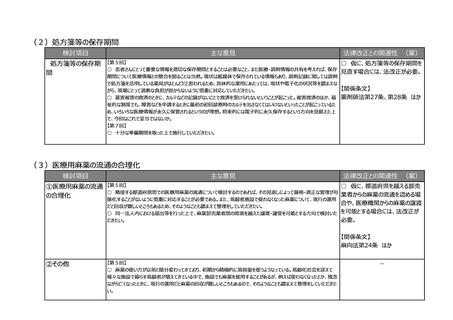
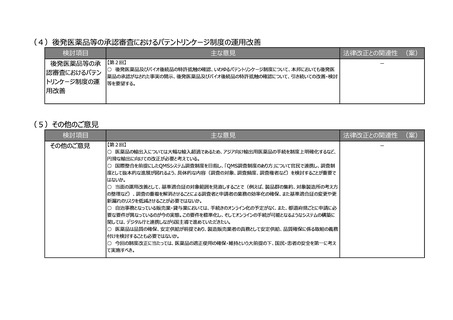
(2)医療上の必要性の高い医薬品への早期アクセスの確保
検討項目
主な意見
法律改正との関連性 (案)
①条件付き承認制
度の見直し
【第3回】
○ 仮に、条件付き承認制度につ
○ 条件付き承認制度を利用・発展していくというところに賛成だが、承認取消も含めて、市販後にもう一回きちんと治
いて取り消し規定を設けた上で、探
験をするという条件を付与するのかしないのか等について慎重に検討していただき、安全性確保と有効性について十分
索的試験の段階で医薬品を早期
検討する必要がある。有効性が確認できない場合に取り消すことが可能かどうかを検討する必要がある。
○ 早期承認、若しくは条件付きで承認された医薬品が、適切に現場で使えるような情報提供や条件を守っているか に承認するベネフィットが、検証的
試験が必要であることによるリスクを
どうかの確認について、調査する必要がある。
○ 医療上の必要性の高い医薬品への早期アクセスの確保は特に重要だが、あくまでも安全性の確保が前提で、安全 上回るものに対して、その臨床的有
性について確認できていること、その上で臨床的有用性が予測可能な場合とすべき。承認を維持することが適切ではな
用性が合理的に予測可能な場合
いことが判明した場合には、速やかに承認を取り消すことを可能とする規定は必要。また、未知の重篤なリスクが出たとき
に、承認を与える制度を設ける場
には迅速な対応ができるようにすることが必要。
○ 取消規定を設けることには賛成だが、患者数が少ないなど、いろいろな理由で今までと同じようなRCTが難しく、効 合には、法改正が必要。
果や安全性の評価ができない薬剤についても、いかに効果や安全性を測る手法を高めていくか、どのように大規模RCT
に代替する手段を持っていくかというのが大事。
【関係条文】
○ 医療機器あるいは体外診断用医薬品についても条件付き承認制度があるが、医薬品と同様に必ずしも利用が進
薬機法第14条 ほか
んでいないというのが実態だと認識しており、方向性は同じであるため医療機器等についても是非議論をお願いしたい。
【第6回】
○ 保険給付すべき有効性、必要性が高い医薬品の安定的な供給を目指すためには、取り消し制度がない方が問題
である。できる限り制度化する方向で検討いただきたい。
【第7回】
○ 探索的臨床試験の段階では治験に参加する患者さんの数も少ないため、特に頻度の低い副作用については、この
段階では分からないということもありうる。特にワクチンに関しては、承認後、大勢の健康な人に使われることになるため、
市販後の安全性の確認については、できるだけしっかりと、かつ、情報公開を迅速にやってもらいたい。
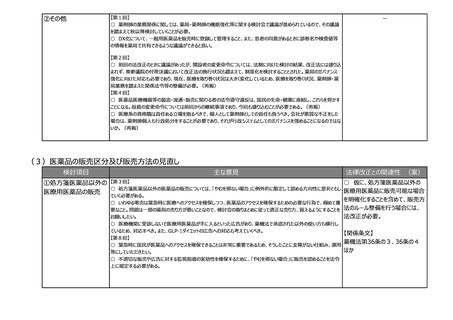
②その他
【第1回】
○ テーマ①や②について、見掛け上は医薬品のことだけを言っているかのような表現も多いが、実際には医療機器も関
連する内容が出てくるため、今後の議論の中で、そういったところはきちんと整理した上で議論が進むことを期待する。
【第6回】
○ 日本では薬事承認されると基本的にすぐ薬価収載されるため、条件付き承認をしたときに安全性に問題がなけれ
ば有効性に疑問があっても残り続けてしまう。薬事の観点での評価結果を踏まえて、保険局で所掌する費用対効果評
価専門部会あるいは専門組織において対応できるような制度設計を構築しないと、全体のヘルスケアシステム自体がコ
スト的に破綻する。
【第7回】
○ 現在、ICHのE6で医薬品の臨床試験実施基準(ガイドライン)が議論されているが、このガイドラインは、国内実装
時に、リスクプロポーショナルアプローチなど、新しい考え方を積極的に導入するなど、国際調和を意識したGCPリノベー
ションを是非お願いしたい。
-3-
-
検討項目
主な意見
法律改正との関連性 (案)
①条件付き承認制
度の見直し
【第3回】
○ 仮に、条件付き承認制度につ
○ 条件付き承認制度を利用・発展していくというところに賛成だが、承認取消も含めて、市販後にもう一回きちんと治
いて取り消し規定を設けた上で、探
験をするという条件を付与するのかしないのか等について慎重に検討していただき、安全性確保と有効性について十分
索的試験の段階で医薬品を早期
検討する必要がある。有効性が確認できない場合に取り消すことが可能かどうかを検討する必要がある。
○ 早期承認、若しくは条件付きで承認された医薬品が、適切に現場で使えるような情報提供や条件を守っているか に承認するベネフィットが、検証的
試験が必要であることによるリスクを
どうかの確認について、調査する必要がある。
○ 医療上の必要性の高い医薬品への早期アクセスの確保は特に重要だが、あくまでも安全性の確保が前提で、安全 上回るものに対して、その臨床的有
性について確認できていること、その上で臨床的有用性が予測可能な場合とすべき。承認を維持することが適切ではな
用性が合理的に予測可能な場合
いことが判明した場合には、速やかに承認を取り消すことを可能とする規定は必要。また、未知の重篤なリスクが出たとき
に、承認を与える制度を設ける場
には迅速な対応ができるようにすることが必要。
○ 取消規定を設けることには賛成だが、患者数が少ないなど、いろいろな理由で今までと同じようなRCTが難しく、効 合には、法改正が必要。
果や安全性の評価ができない薬剤についても、いかに効果や安全性を測る手法を高めていくか、どのように大規模RCT
に代替する手段を持っていくかというのが大事。
【関係条文】
○ 医療機器あるいは体外診断用医薬品についても条件付き承認制度があるが、医薬品と同様に必ずしも利用が進
薬機法第14条 ほか
んでいないというのが実態だと認識しており、方向性は同じであるため医療機器等についても是非議論をお願いしたい。
【第6回】
○ 保険給付すべき有効性、必要性が高い医薬品の安定的な供給を目指すためには、取り消し制度がない方が問題
である。できる限り制度化する方向で検討いただきたい。
【第7回】
○ 探索的臨床試験の段階では治験に参加する患者さんの数も少ないため、特に頻度の低い副作用については、この
段階では分からないということもありうる。特にワクチンに関しては、承認後、大勢の健康な人に使われることになるため、
市販後の安全性の確認については、できるだけしっかりと、かつ、情報公開を迅速にやってもらいたい。
②その他
【第1回】
○ テーマ①や②について、見掛け上は医薬品のことだけを言っているかのような表現も多いが、実際には医療機器も関
連する内容が出てくるため、今後の議論の中で、そういったところはきちんと整理した上で議論が進むことを期待する。
【第6回】
○ 日本では薬事承認されると基本的にすぐ薬価収載されるため、条件付き承認をしたときに安全性に問題がなけれ
ば有効性に疑問があっても残り続けてしまう。薬事の観点での評価結果を踏まえて、保険局で所掌する費用対効果評
価専門部会あるいは専門組織において対応できるような制度設計を構築しないと、全体のヘルスケアシステム自体がコ
スト的に破綻する。
【第7回】
○ 現在、ICHのE6で医薬品の臨床試験実施基準(ガイドライン)が議論されているが、このガイドラインは、国内実装
時に、リスクプロポーショナルアプローチなど、新しい考え方を積極的に導入するなど、国際調和を意識したGCPリノベー
ションを是非お願いしたい。
-3-
-