よむ、つかう、まなぶ。
【参考資料】これまでの議論で出された主な意見.pdf (44 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46170.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第9回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
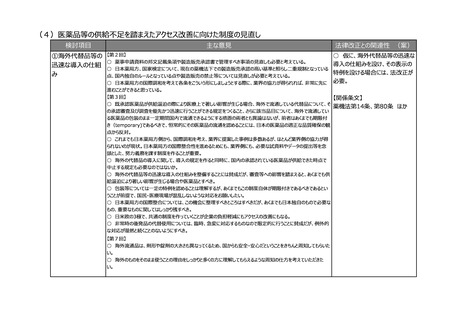
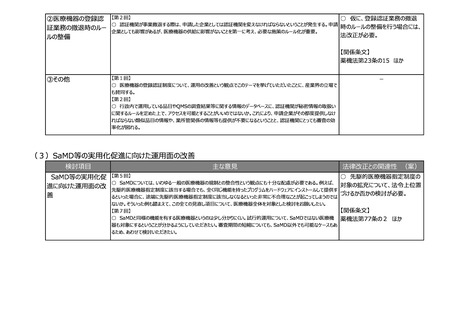
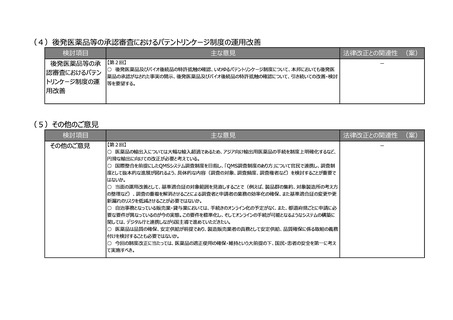
(4)後発医薬品等の承認審査におけるパテントリンケージ制度の運用改善
検討項目
主な意見
法律改正との関連性 (案)
後発医薬品等の承
認審査におけるパテン
トリンケージ制度の運
用改善
【第2回】
○ 後発医薬品及びバイオ後続品の特許抵触の確認、いわゆるパテントリンケージ制度について、本邦においても後発医
薬品の承認がなされた事実の開示、後発医薬品及びバイオ後続品の特許抵触の確認について、引き続いての改善・検討
等を要望する。
-
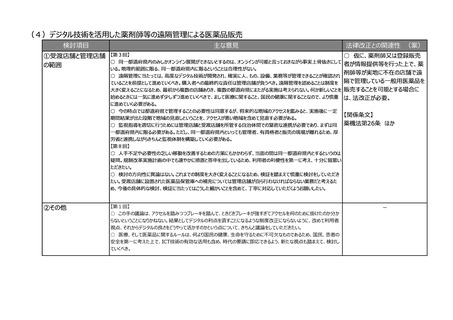
主な意見
法律改正との関連性 (案)
【第2回】
○ 医薬品の輸出入については大幅な輸入超過であるため、アジア向け輸出用医薬品の手続を制度上明確化するなど、
円滑な輸出に向けての改正が必要と考えている。
○ 国際整合を前提にしたQMSシステム調査制度を目指し、「QMS調査制度のあり方」について官民で連携し、調査制
度として抜本的な進展が図れるよう、具体的な内容(調査の対象、調査頻度、調査権者など)を検討することが重要で
はないか。
○ 当面の運用改善として、基準適合証の対象範囲を見直しすることで(例えば、製品群の集約、対象製造所の考え方
の整理など)、調査の重複を解消させることによる調査者と申請者の業務の効率化の確保、また基準適合証の変更や更
新漏れのリスクを低減させることが必要ではないか。
○ 自治事務となっている販売業・貸与業においては、手続きのオンライン化の予定がなく、また、都道府県ごとに申請に必
要な要件が異なっているのが今の実態。この要件を標準化し、そしてオンラインの手続が可能となるようなシステムの構築に
関しては、デジタル庁と連携しながら国主導で進めていただきたい。
○ 医薬品は品質の確保、安定供給が前提であり、製造販売業者の責務として安定供給、品質確保に係る取組の義務
付けを検討することも必要ではないか。
○ 今回の制度改正に当たっては、医薬品の適正使用の確保・維持という大前提の下、国民・患者の安全を第一に考え
て実施すべき。
-
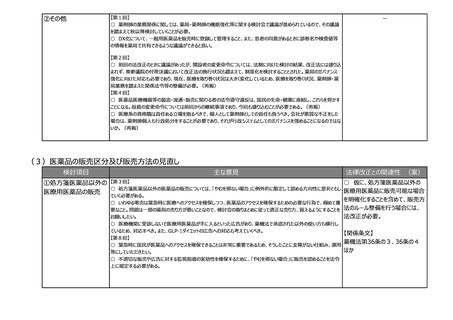
(5)その他のご意見
検討項目
その他のご意見
-44-
検討項目
主な意見
法律改正との関連性 (案)
後発医薬品等の承
認審査におけるパテン
トリンケージ制度の運
用改善
【第2回】
○ 後発医薬品及びバイオ後続品の特許抵触の確認、いわゆるパテントリンケージ制度について、本邦においても後発医
薬品の承認がなされた事実の開示、後発医薬品及びバイオ後続品の特許抵触の確認について、引き続いての改善・検討
等を要望する。
-
主な意見
法律改正との関連性 (案)
【第2回】
○ 医薬品の輸出入については大幅な輸入超過であるため、アジア向け輸出用医薬品の手続を制度上明確化するなど、
円滑な輸出に向けての改正が必要と考えている。
○ 国際整合を前提にしたQMSシステム調査制度を目指し、「QMS調査制度のあり方」について官民で連携し、調査制
度として抜本的な進展が図れるよう、具体的な内容(調査の対象、調査頻度、調査権者など)を検討することが重要で
はないか。
○ 当面の運用改善として、基準適合証の対象範囲を見直しすることで(例えば、製品群の集約、対象製造所の考え方
の整理など)、調査の重複を解消させることによる調査者と申請者の業務の効率化の確保、また基準適合証の変更や更
新漏れのリスクを低減させることが必要ではないか。
○ 自治事務となっている販売業・貸与業においては、手続きのオンライン化の予定がなく、また、都道府県ごとに申請に必
要な要件が異なっているのが今の実態。この要件を標準化し、そしてオンラインの手続が可能となるようなシステムの構築に
関しては、デジタル庁と連携しながら国主導で進めていただきたい。
○ 医薬品は品質の確保、安定供給が前提であり、製造販売業者の責務として安定供給、品質確保に係る取組の義務
付けを検討することも必要ではないか。
○ 今回の制度改正に当たっては、医薬品の適正使用の確保・維持という大前提の下、国民・患者の安全を第一に考え
て実施すべき。
-
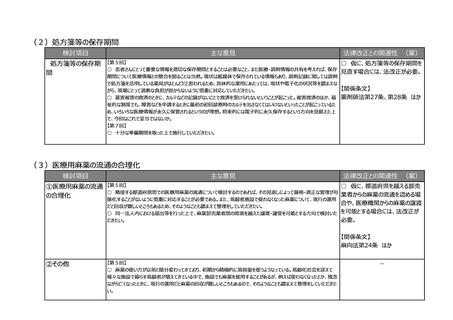
(5)その他のご意見
検討項目
その他のご意見
-44-