よむ、つかう、まなぶ。
【参考資料】これまでの議論で出された主な意見.pdf (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46170.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第9回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
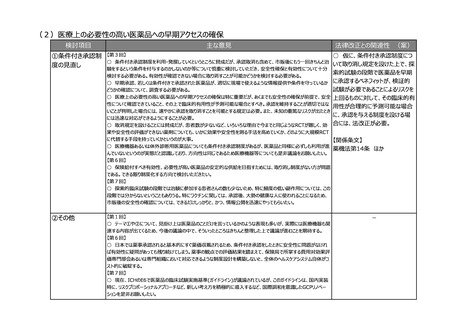
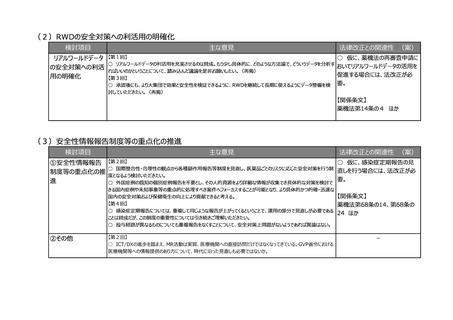
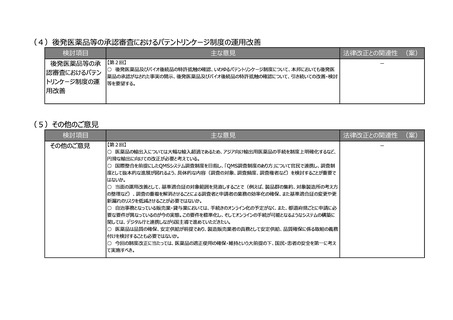
○ 薬機法では、安全管理や品質保証の責任者として、原則、薬剤師という総責が規定されており、省令で総責は品
責、安責を監督し、その意見を尊重すると定められている。品責、安責を法に規定することによって、立場が同等になって
責任が分散してしまうのではないかという危惧がある。むしろ、責任役員と総責の責務を明確にしていく方向のほうが、法
令遵守も含めた全体の製販のガバナンス強化につながるものではないか。
○ 副作用報告等の収集件数がものすごく増加しており、収集ルートもインターネットや患者様の情報など媒体も非常に
多様化している。この機会に安責の役割、あるいは、例えば安全管理業務の委託、再委託等も含めて見直しを検討い
ただきたい。
○ 安全管理の責任者である安責に関しては、やはり市販後の安全対策や承認条件遵守が非常に重要であるが、未
だに不満がある。安責が法律に位置づけられるという形式面だけではなく、今の時代に合った責任の在り方や、本当に機
能するかという観点で制度を考えていただきたい。
【第8回】
○ RMPを法制化することに異論はないが、リスク最小化活動ができているか確認するなど、実効性があるような制度にし
ていただきたい。
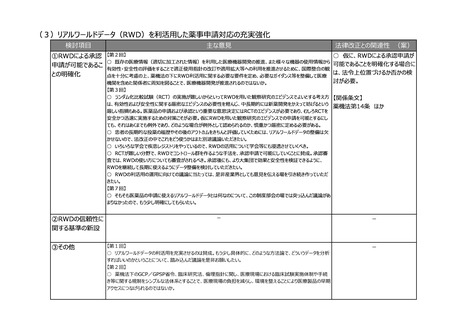
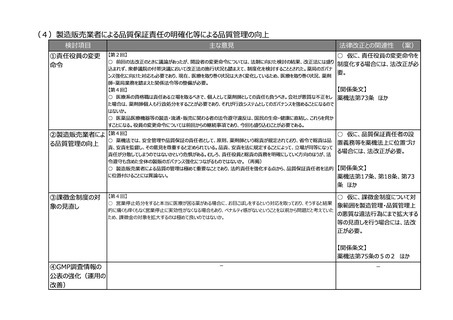
②その他
【第1回】
○ 市販後安全性調査に関して、早期承認や緊急承認等をして、いち早く供給をしたまではいいものの、その後の安全
性、有効性の再確認に資するようなデータの蓄積と、その内容の標準化が明確に確認できるきちんとした信頼性の高い
データベースが、いまだに十分に存在していないようにも思われる。長年の指摘事項であるため、改めて御検討いただきた
い。
【第8回】
○ 商品コードを活用したトレーサビリティの確認は進めていくべき。現場が活用できるように製造側だけではなく、流通
側、医療機関、薬局の意見も聞いて、しっかりと課題を出していただいて進めていただきたい。
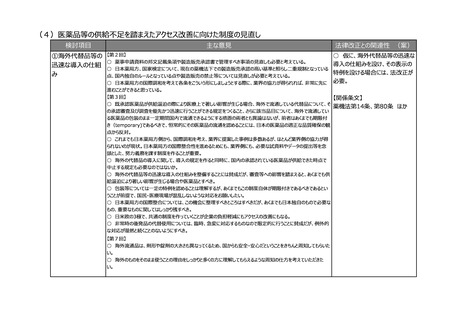
○ 医薬品・医療機器の製品データベースへの登録の悉皆性を確保する必要性については、業界の立場でも賛同する。
義務化及び国際整合といった観点からは、必要最低限のデータ項目からなる公的データベースであるべきであり、関連す
るデータベースとの連携が極めて重要である。PMDAが管理している添付文書は既に同じバーコードを利用してアクセスし
ている状況であり、重複した入力が求められることがないように整理していただきたい。
○ 記録を適切に管理できるため、薬害被害者の救済という観点からも今回の改定は画期的である。
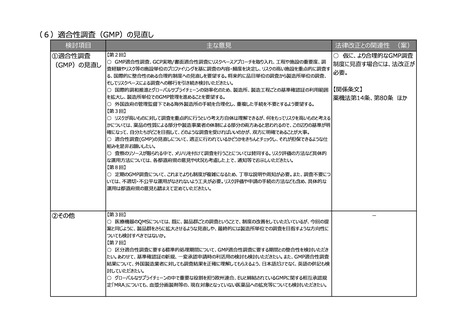
-13-
-
責、安責を監督し、その意見を尊重すると定められている。品責、安責を法に規定することによって、立場が同等になって
責任が分散してしまうのではないかという危惧がある。むしろ、責任役員と総責の責務を明確にしていく方向のほうが、法
令遵守も含めた全体の製販のガバナンス強化につながるものではないか。
○ 副作用報告等の収集件数がものすごく増加しており、収集ルートもインターネットや患者様の情報など媒体も非常に
多様化している。この機会に安責の役割、あるいは、例えば安全管理業務の委託、再委託等も含めて見直しを検討い
ただきたい。
○ 安全管理の責任者である安責に関しては、やはり市販後の安全対策や承認条件遵守が非常に重要であるが、未
だに不満がある。安責が法律に位置づけられるという形式面だけではなく、今の時代に合った責任の在り方や、本当に機
能するかという観点で制度を考えていただきたい。
【第8回】
○ RMPを法制化することに異論はないが、リスク最小化活動ができているか確認するなど、実効性があるような制度にし
ていただきたい。
②その他
【第1回】
○ 市販後安全性調査に関して、早期承認や緊急承認等をして、いち早く供給をしたまではいいものの、その後の安全
性、有効性の再確認に資するようなデータの蓄積と、その内容の標準化が明確に確認できるきちんとした信頼性の高い
データベースが、いまだに十分に存在していないようにも思われる。長年の指摘事項であるため、改めて御検討いただきた
い。
【第8回】
○ 商品コードを活用したトレーサビリティの確認は進めていくべき。現場が活用できるように製造側だけではなく、流通
側、医療機関、薬局の意見も聞いて、しっかりと課題を出していただいて進めていただきたい。
○ 医薬品・医療機器の製品データベースへの登録の悉皆性を確保する必要性については、業界の立場でも賛同する。
義務化及び国際整合といった観点からは、必要最低限のデータ項目からなる公的データベースであるべきであり、関連す
るデータベースとの連携が極めて重要である。PMDAが管理している添付文書は既に同じバーコードを利用してアクセスし
ている状況であり、重複した入力が求められることがないように整理していただきたい。
○ 記録を適切に管理できるため、薬害被害者の救済という観点からも今回の改定は画期的である。
-13-
-