よむ、つかう、まなぶ。
資料2.セルフケア・セルフメディケーション推進の取組 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_48502.html |
| 出典情報 | セルフケア・セルフメディケーション推進に関する有識者検討会(第1回 1/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
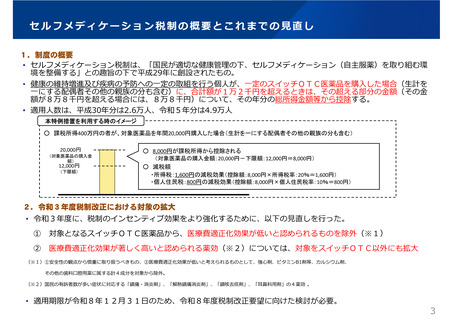
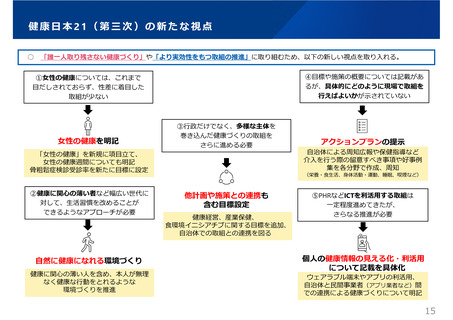
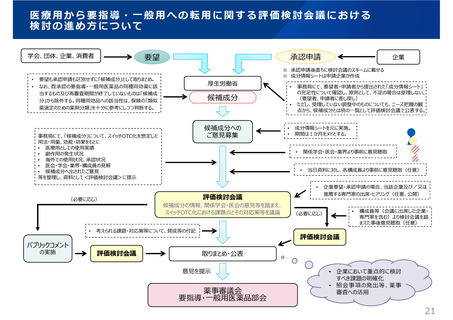
医療⽤から要指導・⼀般⽤への転⽤に関する評価検討会議における
検討の進め方について
学会、団体、企業、消費者
•
•
承認申請
要望
※ 承認申請後直ちに検討会議のスキームに載せる
※ 成分情報シートは申請企業が作成
要望も承認申請も区別せずに「候補成分」として取りまとめ。
なお、既承認の要指導・一般用医薬品の同種同効薬に該
当するもの及び再審査期間が終了していないものは「候補成
分」から除外する。同種同効品への該当性は、保険の「類似
薬選定のための薬剤分類」を十分に参考にしつつ判断する。
厚⽣労働省
•
候補成分
•
候補成分への
ご意⾒募集
事務局にて、「候補成分」について、スイッチOTC化を想定した
用法・⽤量、効能・効果をもとに
• 医療⽤としての使⽤実績
• 副作用の発生状況
• 海外での使用状況、承認状況
• 医会・学会・業界・構成員の⾒解
• 候補成分へ出されたご意⾒
等を整理し、資料として<評価検討会議>に提⽰
•
•
事務局にて、要望者・申請者から提出された「成分情報シート」
の充足性について確認し、原則として、不⾜の場合は受理しない。
(要望者、申請者に差し戻し)
ただし、受理していない調整中のものについても、ニーズ把握の観
点から、候補成分とは別の一覧として評価検討会議で公表する。
成分情報シートを元に実施。
期間は1か月をメドとする。
関係学会・医会・業界より事前に意⾒聴取
•
•
当⽇資料に対し、各構成員より事前に意⾒聴取(任意)
•
(必要に応じ)
•
パブリックコメント
の実施
評価検討会議
候補成分の情報、関係学会・医会の意⾒等を踏まえ、
スイッチOTC化における課題点とその対応策等を議論
考えられる課題・対応策等について、賛成等の付記
評価検討会議
企業
企業要望・承認申請の場合、当該企業及び/又は
推薦する専門家の出席・ヒアリング(任意、公開)
•
(必要に応じ)
構成員等(会議に出席した企業・
専門家を含む)より検討会議を踏
まえた事後意⾒聴取(任意)
評価検討会議
取りまとめ・公表
意⾒を提⽰
薬事審議会
要指導・一般用医薬品部会
• 企業において重点的に検討
すべき課題の明確化
• 照会事項の発出等、薬事
審査への活用
21
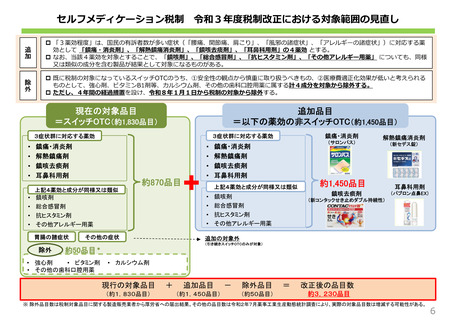
検討の進め方について
学会、団体、企業、消費者
•
•
承認申請
要望
※ 承認申請後直ちに検討会議のスキームに載せる
※ 成分情報シートは申請企業が作成
要望も承認申請も区別せずに「候補成分」として取りまとめ。
なお、既承認の要指導・一般用医薬品の同種同効薬に該
当するもの及び再審査期間が終了していないものは「候補成
分」から除外する。同種同効品への該当性は、保険の「類似
薬選定のための薬剤分類」を十分に参考にしつつ判断する。
厚⽣労働省
•
候補成分
•
候補成分への
ご意⾒募集
事務局にて、「候補成分」について、スイッチOTC化を想定した
用法・⽤量、効能・効果をもとに
• 医療⽤としての使⽤実績
• 副作用の発生状況
• 海外での使用状況、承認状況
• 医会・学会・業界・構成員の⾒解
• 候補成分へ出されたご意⾒
等を整理し、資料として<評価検討会議>に提⽰
•
•
事務局にて、要望者・申請者から提出された「成分情報シート」
の充足性について確認し、原則として、不⾜の場合は受理しない。
(要望者、申請者に差し戻し)
ただし、受理していない調整中のものについても、ニーズ把握の観
点から、候補成分とは別の一覧として評価検討会議で公表する。
成分情報シートを元に実施。
期間は1か月をメドとする。
関係学会・医会・業界より事前に意⾒聴取
•
•
当⽇資料に対し、各構成員より事前に意⾒聴取(任意)
•
(必要に応じ)
•
パブリックコメント
の実施
評価検討会議
候補成分の情報、関係学会・医会の意⾒等を踏まえ、
スイッチOTC化における課題点とその対応策等を議論
考えられる課題・対応策等について、賛成等の付記
評価検討会議
企業
企業要望・承認申請の場合、当該企業及び/又は
推薦する専門家の出席・ヒアリング(任意、公開)
•
(必要に応じ)
構成員等(会議に出席した企業・
専門家を含む)より検討会議を踏
まえた事後意⾒聴取(任意)
評価検討会議
取りまとめ・公表
意⾒を提⽰
薬事審議会
要指導・一般用医薬品部会
• 企業において重点的に検討
すべき課題の明確化
• 照会事項の発出等、薬事
審査への活用
21