よむ、つかう、まなぶ。
総-3ー1最適使用推進ガイドライン チルゼパチド [793KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
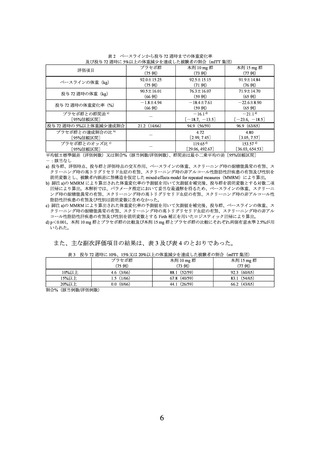
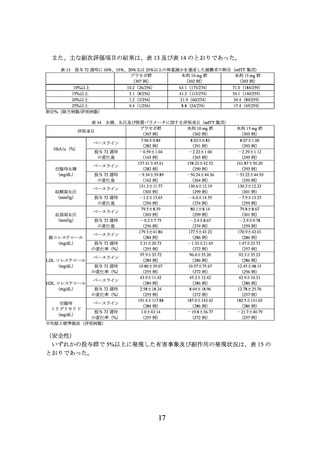
タンパク質からはエネルギーの約 20%
脂質からはエネルギーの最大 30%
推定一日総エネルギー消費量(total energy expenditure:TEE)※2 から約 500 kcal
差し引いたエネルギー摂取量
※2 TEE(kcal/日)=基礎代謝率(Basal Metabolic Rate:BMR)※3×1.3
※3 BMR の推算式は以下のとおり
性別
男性
女性
•
年齢
18~30 歳
31~60 歳
60 歳超
18~30 歳
31~60 歳
60 歳超
BMR(kcal/日)
15.057×実際の体重(kg)+692.2
11.472×実際の体重(kg)+873.1
11.711×実際の体重(kg)+587.7
14.818×実際の体重(kg)+486.6
8.126×実際の体重(kg)+845.6
9.082×実際の体重(kg)+658.5
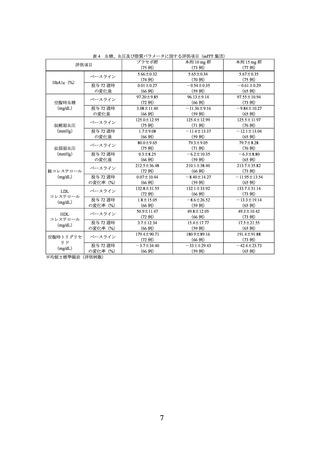
運動療法
無作為割付時及びその後のすべての来院で、1 週間あたり 150 分以上の運動を推
奨することとされた。
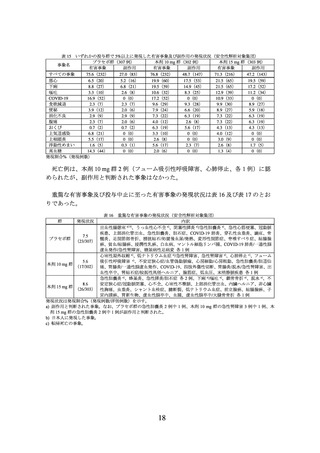
【結果】
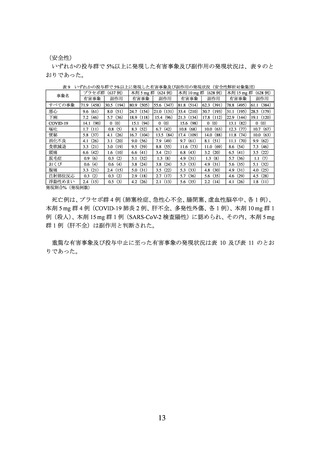
無作為割付けされた 2539 例(プラセボ群 643 例(日本人 33 例)
、本剤 5 mg 群 630 例
(日本人 30 例)
、本剤 10 mg 群 636 例(日本人 30 例)
、本剤 15 mg 群 630 例(日本人
31 例))全例が治験薬の投与を 1 回以上受け、その内、2517 例7)(プラセボ群 637 例(日
本人 27 例)
、本剤 5 mg 群 624 例(日本人 24 例)
、本剤 10 mg 群 628 例(日本人 22 例)
、
本剤 15 mg 群 628 例(日本人 29 例))が mITT 集団及び安全性解析対象集団とされ、
mITT 集団が主な有効性解析対象集団とされた。
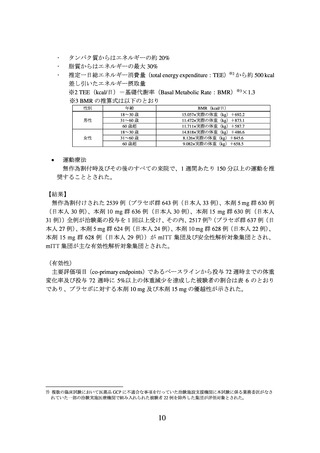
(有効性)
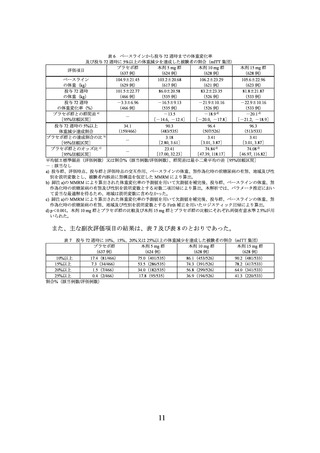
主要評価項目(co-primary endpoints)であるベースラインから投与 72 週時までの体重
変化率及び投与 72 週時に 5%以上の体重減少を達成した被験者の割合は表 6 のとおり
であり、プラセボに対する本剤 10 mg 及び本剤 15 mg の優越性が示された。
7) 複数の臨床試験において医薬品 GCP に不適合な事項を行っていた治験施設支援機関に本試験に係る業務委託がなさ
れていた一部の治験実施医療機関で組み入れられた被験者 22 例を除外した集団が評価対象とされた。
10
タンパク質からはエネルギーの約 20%
脂質からはエネルギーの最大 30%
推定一日総エネルギー消費量(total energy expenditure:TEE)※2 から約 500 kcal
差し引いたエネルギー摂取量
※2 TEE(kcal/日)=基礎代謝率(Basal Metabolic Rate:BMR)※3×1.3
※3 BMR の推算式は以下のとおり
性別
男性
女性
•
年齢
18~30 歳
31~60 歳
60 歳超
18~30 歳
31~60 歳
60 歳超
BMR(kcal/日)
15.057×実際の体重(kg)+692.2
11.472×実際の体重(kg)+873.1
11.711×実際の体重(kg)+587.7
14.818×実際の体重(kg)+486.6
8.126×実際の体重(kg)+845.6
9.082×実際の体重(kg)+658.5
運動療法
無作為割付時及びその後のすべての来院で、1 週間あたり 150 分以上の運動を推
奨することとされた。
【結果】
無作為割付けされた 2539 例(プラセボ群 643 例(日本人 33 例)
、本剤 5 mg 群 630 例
(日本人 30 例)
、本剤 10 mg 群 636 例(日本人 30 例)
、本剤 15 mg 群 630 例(日本人
31 例))全例が治験薬の投与を 1 回以上受け、その内、2517 例7)(プラセボ群 637 例(日
本人 27 例)
、本剤 5 mg 群 624 例(日本人 24 例)
、本剤 10 mg 群 628 例(日本人 22 例)
、
本剤 15 mg 群 628 例(日本人 29 例))が mITT 集団及び安全性解析対象集団とされ、
mITT 集団が主な有効性解析対象集団とされた。
(有効性)
主要評価項目(co-primary endpoints)であるベースラインから投与 72 週時までの体重
変化率及び投与 72 週時に 5%以上の体重減少を達成した被験者の割合は表 6 のとおり
であり、プラセボに対する本剤 10 mg 及び本剤 15 mg の優越性が示された。
7) 複数の臨床試験において医薬品 GCP に不適合な事項を行っていた治験施設支援機関に本試験に係る業務委託がなさ
れていた一部の治験実施医療機関で組み入れられた被験者 22 例を除外した集団が評価対象とされた。
10