よむ、つかう、まなぶ。
総-3ー1最適使用推進ガイドライン チルゼパチド [793KB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
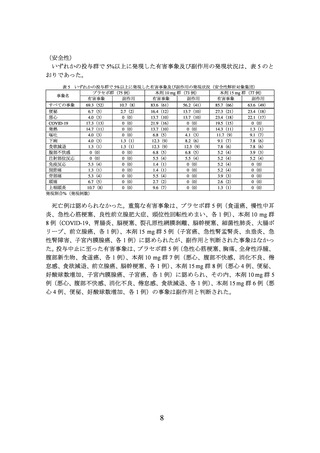
ングを受けることとされた。なお、患者には、各カウンセリング来院前 3 日間の食
事の内容及び身体活動の内容を日誌に記入することが推奨された。
炭水化物からはエネルギーの約 50~60%
タンパク質からはエネルギーの約 15~20%
脂質からはエネルギーの約 20~25%
BMI が 27 kg/m2 以上である患者の 1 日のエネルギー摂取量は最大 25 kcal/kg×
標準体重(BMI:22 kg/m2 とする)、BMI が 35 kg/m2 以上である患者の 1 日の
エネルギー摂取量は最大 20~25 kcal/kg×標準体重を目安とする
•
運動療法
無作為割付時及びその後のすべての来院で、1 週間あたり 150 分以上の運動を推
奨することとされた。
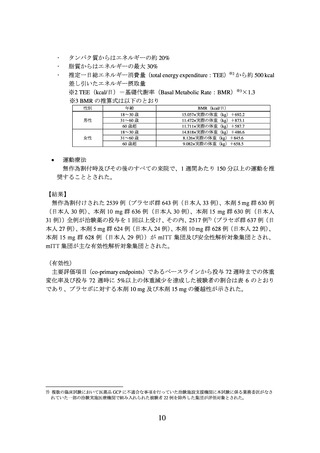
【結果】
無作為割付けされた 267 例(プラセボ群 89 例、本剤 10 mg 群 88 例、本剤 15 mg 群
90 例)全例が治験薬の投与を 1 回以上受け、その内、225 例4)(プラセボ群 75 例、本
剤 10 mg 群 73 例、本剤 15 mg 群 77 例)が mITT 集団及び安全性解析対象集団とされ、
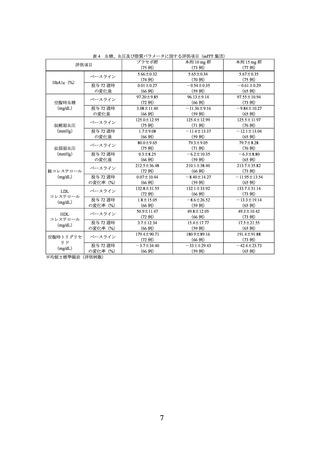
mITT 集団が主な有効性解析対象集団とされた。肥満に関連する各健康障害を有する被
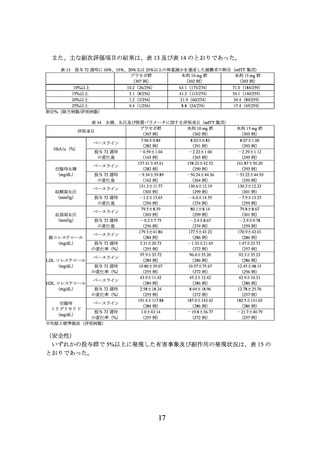
験者の割合は表 1 のとおりであった。
表 1 肥満に関連する各健康障害を有する被験者の割合(mITT 集団)
肥満に関連する健康障害
全体
耐糖能異常
65.8(148/225)
脂質異常症
89.3(201/225)
高血圧
53.3(120/225)
高尿酸血症・痛風
35.6(80/225)
冠動脈疾患
2.2(5/225)
脳梗塞
0(0/225)
非アルコール性脂肪性肝疾患
98.2(221/225)
月経異常・女性不妊
2.2(5/225)
閉塞性睡眠時無呼吸症候群・肥満低換気症候群
8.9(20/225)
運動器疾患
8.0(18/225)
肥満関連腎臓病
割合%(該当例数/評価例数)
4.0(9/225)
(有効性)
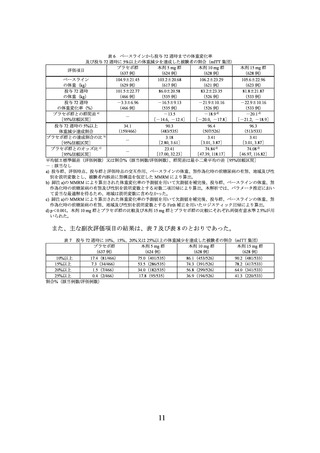
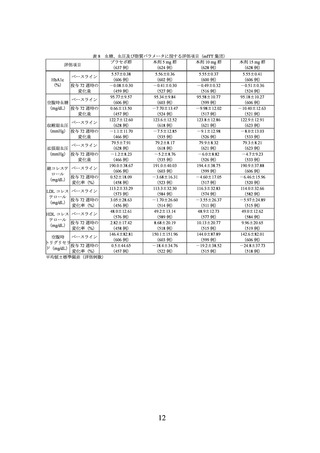
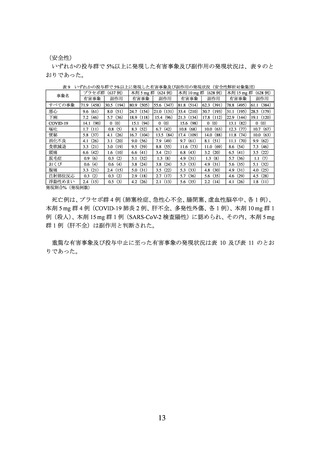
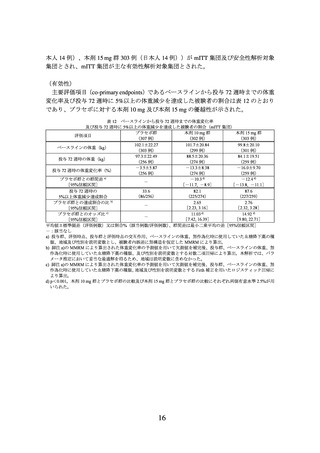
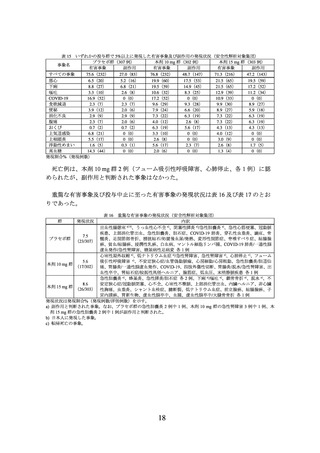
主要評価項目(co-primary endpoints)であるベースラインから投与 72 週時までの体重
変化率及び投与 72 週時に 5%以上の体重減少を達成した被験者の割合は表 2 のとおり
であり、プラセボに対する本剤 10 mg 及び本剤 15 mg の優越性が示された。
4) 複数の臨床試験において医薬品 GCP に不適合な事項を行っていた治験施設支援機関に本試験に係る業務委託がなさ
れていた一部の治験実施医療機関で組み入れられた被験者 42 例を除外した集団が評価対象とされた。
5
事の内容及び身体活動の内容を日誌に記入することが推奨された。
炭水化物からはエネルギーの約 50~60%
タンパク質からはエネルギーの約 15~20%
脂質からはエネルギーの約 20~25%
BMI が 27 kg/m2 以上である患者の 1 日のエネルギー摂取量は最大 25 kcal/kg×
標準体重(BMI:22 kg/m2 とする)、BMI が 35 kg/m2 以上である患者の 1 日の
エネルギー摂取量は最大 20~25 kcal/kg×標準体重を目安とする
•
運動療法
無作為割付時及びその後のすべての来院で、1 週間あたり 150 分以上の運動を推
奨することとされた。
【結果】
無作為割付けされた 267 例(プラセボ群 89 例、本剤 10 mg 群 88 例、本剤 15 mg 群
90 例)全例が治験薬の投与を 1 回以上受け、その内、225 例4)(プラセボ群 75 例、本
剤 10 mg 群 73 例、本剤 15 mg 群 77 例)が mITT 集団及び安全性解析対象集団とされ、
mITT 集団が主な有効性解析対象集団とされた。肥満に関連する各健康障害を有する被
験者の割合は表 1 のとおりであった。
表 1 肥満に関連する各健康障害を有する被験者の割合(mITT 集団)
肥満に関連する健康障害
全体
耐糖能異常
65.8(148/225)
脂質異常症
89.3(201/225)
高血圧
53.3(120/225)
高尿酸血症・痛風
35.6(80/225)
冠動脈疾患
2.2(5/225)
脳梗塞
0(0/225)
非アルコール性脂肪性肝疾患
98.2(221/225)
月経異常・女性不妊
2.2(5/225)
閉塞性睡眠時無呼吸症候群・肥満低換気症候群
8.9(20/225)
運動器疾患
8.0(18/225)
肥満関連腎臓病
割合%(該当例数/評価例数)
4.0(9/225)
(有効性)
主要評価項目(co-primary endpoints)であるベースラインから投与 72 週時までの体重
変化率及び投与 72 週時に 5%以上の体重減少を達成した被験者の割合は表 2 のとおり
であり、プラセボに対する本剤 10 mg 及び本剤 15 mg の優越性が示された。
4) 複数の臨床試験において医薬品 GCP に不適合な事項を行っていた治験施設支援機関に本試験に係る業務委託がなさ
れていた一部の治験実施医療機関で組み入れられた被験者 42 例を除外した集団が評価対象とされた。
5