よむ、つかう、まなぶ。
総-3ー1最適使用推進ガイドライン チルゼパチド [793KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
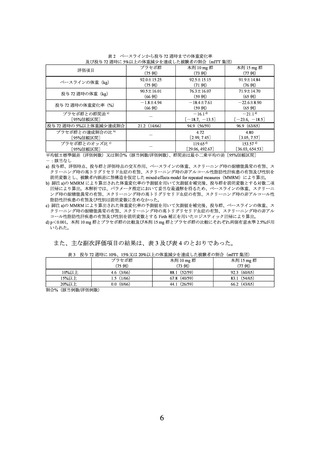
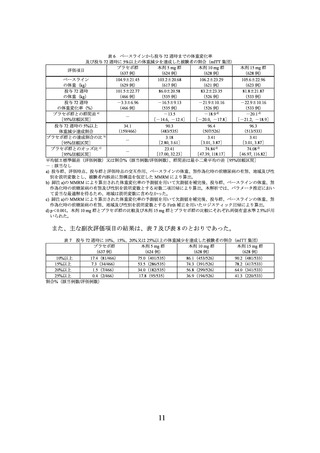
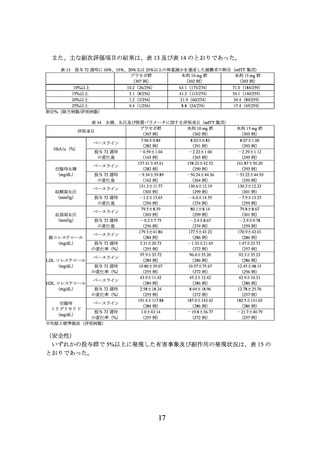
表 2 ベースラインから投与 72 週時までの体重変化率
及び投与 72 週時に 5%以上の体重減少を達成した被験者の割合(mITT 集団)
プラセボ群
本剤 10 mg 群
本剤 15 mg 群
評価項目
(75 例)
(73 例)
(77 例)
92.0±15.25
92.5±15.15
91.9±14.84
ベースラインの体重(kg)
(75 例)
(71 例)
(76 例)
90.5±16.01
76.3±16.07
71.9±14.70
投与 72 週時の体重(kg)
(66 例)
(59 例)
(65 例)
-1.8±4.94
-18.4±7.61
-22.6±8.90
投与 72 週時の体重変化率(%)
(66 例)
(59 例)
(65 例)
プラセボ群との群間差 a)
-16.1 d)
-21.1 d)
-
[95%信頼区間]
[-18.7, -13.5]
[-23.6, -18.5]
投与 72 週時の 5%以上体重減少達成割合
21.2(14/66)
94.9(56/59)
96.9(63/65)
プラセボ群との達成割合の比 b)
4.72
4.80
-
[2.99, 7.45]
[3.05, 7.57]
[95%信頼区間]
プラセボ群とのオッズ比 c)
119.65 d)
153.57 d)
-
[29.06,
492.67]
[36.03,
654.53]
[95%信頼区間]
平均値±標準偏差(評価例数)又は割合%(該当例数/評価例数)、群間差は最小二乗平均の差[95%信頼区間]
-:該当なし
a) 投与群、評価時点、投与群と評価時点の交互作用、ベースラインの体重、スクリーニング時の耐糖能異常の有無、ス
クリーニング時の高トリグリセリド血症の有無、スクリーニング時の非アルコール性脂肪性肝疾患の有無及び性別を
説明変数とし、被験者内誤差に無構造を仮定した mixed-effects model for repeated measures(MMRM)により算出。
b) 脚注 a)の MMRM により算出された体重変化率の予測値を用いて欠測値を補完後、投与群を説明変数とする対数二項
回帰により算出。本解析では、パラメータ推定において妥当な最適解を得るため、ベースラインの体重、スクリーニ
ング時の耐糖能異常の有無、スクリーニング時の高トリグリセリド血症の有無、スクリーニング時の非アルコール性
脂肪性肝疾患の有無及び性別は説明変数に含めなかった。
c) 脚注 a)の MMRM により算出された体重変化率の予測値を用いて欠測値を補完後、投与群、ベースラインの体重、ス
クリーニング時の耐糖能異常の有無、スクリーニング時の高トリグリセリド血症の有無、スクリーニング時の非アル
コール性脂肪性肝疾患の有無及び性別を説明変数とする Firth 補正を用いたロジスティック回帰により算出。
d) p<0.001。本剤 10 mg 群とプラセボ群の比較及び本剤 15 mg 群とプラセボ群の比較にそれぞれ両側有意水準 2.5%が用
いられた。
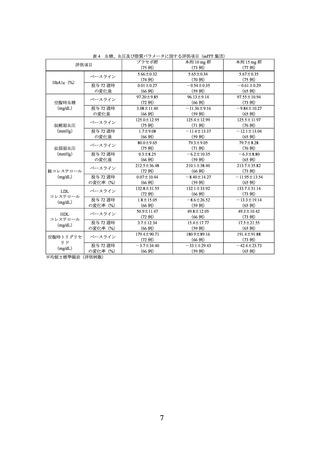
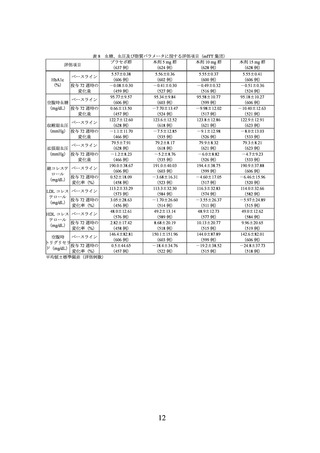
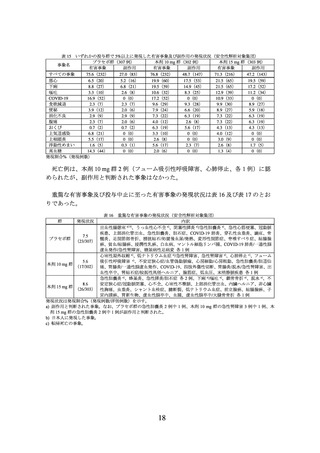
また、主な副次評価項目の結果は、表 3 及び表 4 のとおりであった。
表 3 投与 72 週時に 10%、15%又は 20%以上の体重減少を達成した被験者の割合(mITT 集団)
プラセボ群
本剤 10 mg 群
本剤 15 mg 群
(75 例)
(73 例)
(77 例)
10%以上
4.6(3/66)
88.1(52/59)
92.3(60/65)
15%以上
1.5(1/66)
67.8(40/59)
83.1(54/65)
20%以上
0.0(0/66)
44.1(26/59)
66.2(43/65)
割合%(該当例数/評価例数)
6
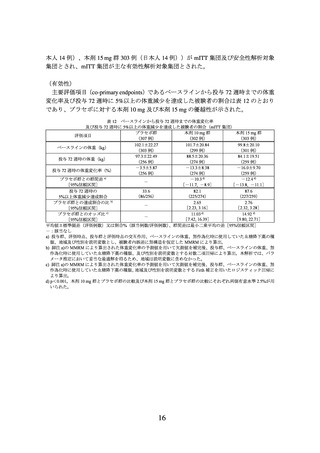
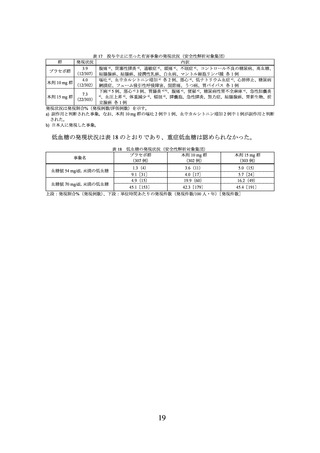
及び投与 72 週時に 5%以上の体重減少を達成した被験者の割合(mITT 集団)
プラセボ群
本剤 10 mg 群
本剤 15 mg 群
評価項目
(75 例)
(73 例)
(77 例)
92.0±15.25
92.5±15.15
91.9±14.84
ベースラインの体重(kg)
(75 例)
(71 例)
(76 例)
90.5±16.01
76.3±16.07
71.9±14.70
投与 72 週時の体重(kg)
(66 例)
(59 例)
(65 例)
-1.8±4.94
-18.4±7.61
-22.6±8.90
投与 72 週時の体重変化率(%)
(66 例)
(59 例)
(65 例)
プラセボ群との群間差 a)
-16.1 d)
-21.1 d)
-
[95%信頼区間]
[-18.7, -13.5]
[-23.6, -18.5]
投与 72 週時の 5%以上体重減少達成割合
21.2(14/66)
94.9(56/59)
96.9(63/65)
プラセボ群との達成割合の比 b)
4.72
4.80
-
[2.99, 7.45]
[3.05, 7.57]
[95%信頼区間]
プラセボ群とのオッズ比 c)
119.65 d)
153.57 d)
-
[29.06,
492.67]
[36.03,
654.53]
[95%信頼区間]
平均値±標準偏差(評価例数)又は割合%(該当例数/評価例数)、群間差は最小二乗平均の差[95%信頼区間]
-:該当なし
a) 投与群、評価時点、投与群と評価時点の交互作用、ベースラインの体重、スクリーニング時の耐糖能異常の有無、ス
クリーニング時の高トリグリセリド血症の有無、スクリーニング時の非アルコール性脂肪性肝疾患の有無及び性別を
説明変数とし、被験者内誤差に無構造を仮定した mixed-effects model for repeated measures(MMRM)により算出。
b) 脚注 a)の MMRM により算出された体重変化率の予測値を用いて欠測値を補完後、投与群を説明変数とする対数二項
回帰により算出。本解析では、パラメータ推定において妥当な最適解を得るため、ベースラインの体重、スクリーニ
ング時の耐糖能異常の有無、スクリーニング時の高トリグリセリド血症の有無、スクリーニング時の非アルコール性
脂肪性肝疾患の有無及び性別は説明変数に含めなかった。
c) 脚注 a)の MMRM により算出された体重変化率の予測値を用いて欠測値を補完後、投与群、ベースラインの体重、ス
クリーニング時の耐糖能異常の有無、スクリーニング時の高トリグリセリド血症の有無、スクリーニング時の非アル
コール性脂肪性肝疾患の有無及び性別を説明変数とする Firth 補正を用いたロジスティック回帰により算出。
d) p<0.001。本剤 10 mg 群とプラセボ群の比較及び本剤 15 mg 群とプラセボ群の比較にそれぞれ両側有意水準 2.5%が用
いられた。
また、主な副次評価項目の結果は、表 3 及び表 4 のとおりであった。
表 3 投与 72 週時に 10%、15%又は 20%以上の体重減少を達成した被験者の割合(mITT 集団)
プラセボ群
本剤 10 mg 群
本剤 15 mg 群
(75 例)
(73 例)
(77 例)
10%以上
4.6(3/66)
88.1(52/59)
92.3(60/65)
15%以上
1.5(1/66)
67.8(40/59)
83.1(54/65)
20%以上
0.0(0/66)
44.1(26/59)
66.2(43/65)
割合%(該当例数/評価例数)
6