よむ、つかう、まなぶ。
総-3ー1最適使用推進ガイドライン チルゼパチド [793KB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
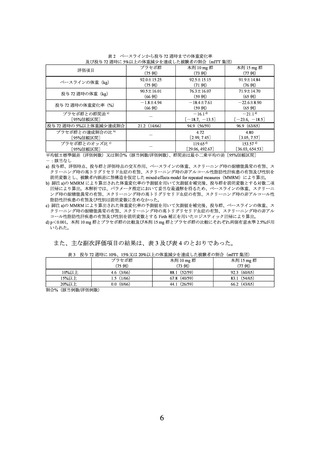
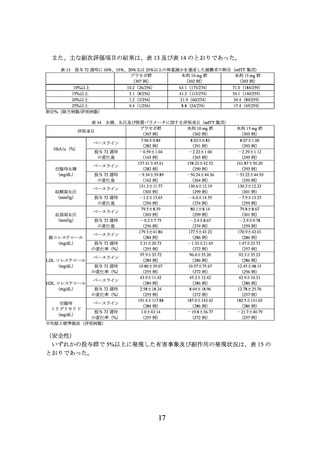
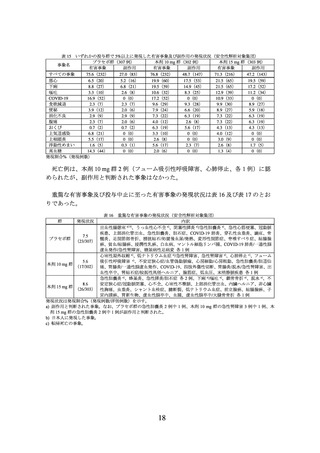
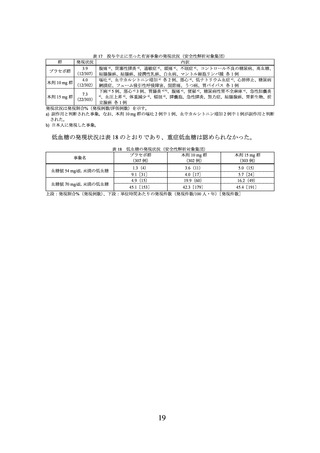
3.臨床成績
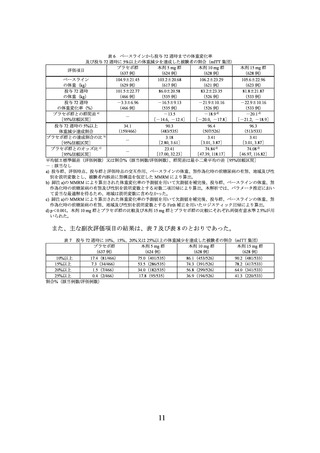
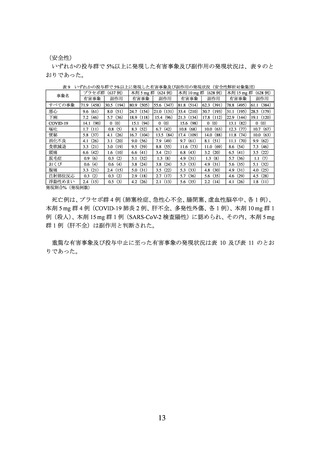
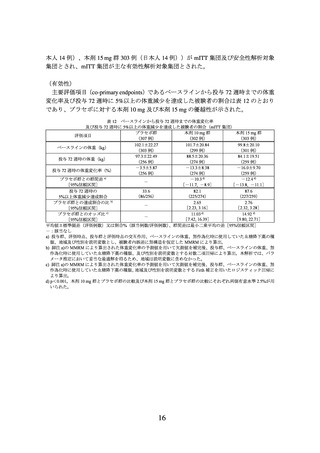
製造販売承認時に評価を行った主な臨床試験の成績を示す。
(1) 肥満症患者を対象とした国内第 III 相試験(I8F-JE-GPHZ 試験)
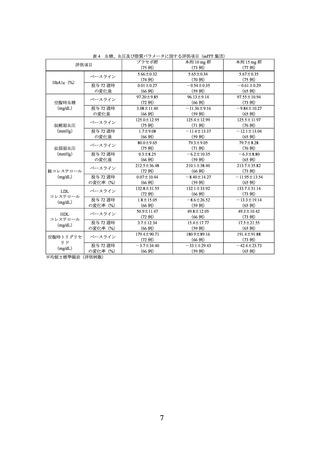
【試験デザインの概要】
日本人肥満症患者(目標被験者数 261 例、各群 87 例)を対象に、食事療法及び運動
療法施行下での本剤の有効性及び安全性を検討するため、プラセボ対照無作為化二重盲
検並行群間比較試験が実施された。
用法・用量は、プラセボ、本剤 10 mg 又は本剤 15 mg を週 1 回、腹部又は大腿部に皮
下投与(自己注射)とされた。本剤の開始用量は 2.5 mg とされ、各維持用量(10 mg 又
は 15 mg)に達するまで 4 週間毎に 2.5 mg ずつ増量することとされた。なお、忍容でき
ない胃腸症状が認められた被験者は、1 回のみ減量(15 mg と 12.5 mg を 10 mg に減
量、10 mg 以下をプラセボに変更)することが可能とされ、減量しても忍容できない胃
腸症状が認められる場合は中止することとされた。
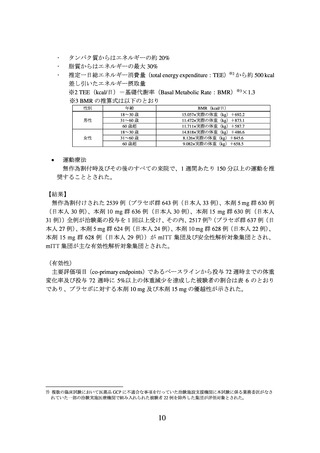
有効性の主要評価項目(co-primary endpoints)は、ベースラインから投与 72 週時まで
の体重変化率及び投与 72 週時に 5%以上の体重減少を達成した被験者の割合とされた。
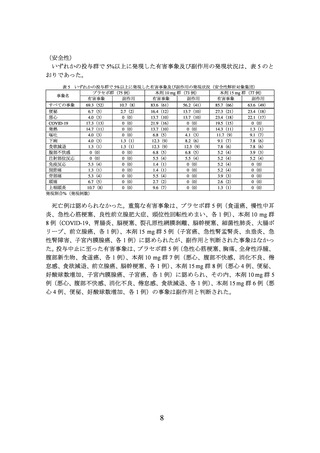
(主な選択基準)
• 20 歳以上
• BMI が 27 kg/m2 以上で 2 つ以上の肥満に関連する健康障害※1 を有する
又は
BMI が 35 kg/m2 以上であり 1 つ以上の肥満に関連する健康障害※1 を有する
※1 肥満に関連する健康障害は、耐糖能異常1)、高トリグリセリド血症2)又は非ア
ルコール性脂肪性肝疾患3)のいずれかとされた
• 体重を減少させるための食事の取組みに 1 回以上失敗している(自己申告)
(主な除外基準)
• 糖尿病の既往歴を有する
(食事療法及び運動療法)
試験期間中、患者には 0、4、8、12、24、36、48、52、60 及び 72 週時に食事・運動
療法のカウンセリングが行われた。
•
食事療法
治験スケジュールに従って、JASSO のガイドラインに基づき、患者は、以下に示
すエネルギー摂取制限と主要栄養素のバランスに焦点をあてた食事のカウンセリ
1) Visit 2(治験薬投与開始 2 週間前、以下同様)で実施する経口グルコース負荷試験(OGTT)の結果、0 時間グルコー
ス値が 110 mg/dL 以上又は 2 時間グルコース値が 140 mg/dL 以上であり、Visit 1(治験薬投与開始 4 週間前、以下同様)
及び Visit 2 において糖尿病の診断基準を満たさない。本治験では、日本の糖尿病診療ガイドライン 2019(J Diabetes
Investig; 2020: 11: 1020-76)の「境界型」に該当する空腹時血糖異常も含まれるよう耐糖能異常が定義された。
2) Visit 1 及び Visit 2 の空腹時トリグリセリドが 150mg/dL 以上である。
3) Visit 2 の MRI プロトン密度脂肪率(中央測定機関による評価)で測定した肝臓脂肪含有率(HFF)が 5%以上である。
4
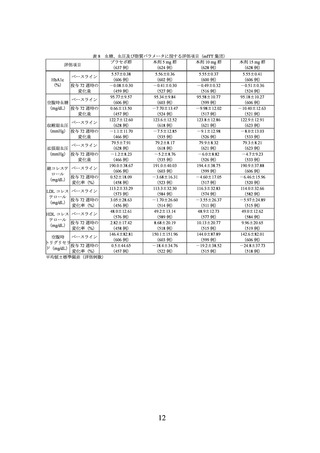
製造販売承認時に評価を行った主な臨床試験の成績を示す。
(1) 肥満症患者を対象とした国内第 III 相試験(I8F-JE-GPHZ 試験)
【試験デザインの概要】
日本人肥満症患者(目標被験者数 261 例、各群 87 例)を対象に、食事療法及び運動
療法施行下での本剤の有効性及び安全性を検討するため、プラセボ対照無作為化二重盲
検並行群間比較試験が実施された。
用法・用量は、プラセボ、本剤 10 mg 又は本剤 15 mg を週 1 回、腹部又は大腿部に皮
下投与(自己注射)とされた。本剤の開始用量は 2.5 mg とされ、各維持用量(10 mg 又
は 15 mg)に達するまで 4 週間毎に 2.5 mg ずつ増量することとされた。なお、忍容でき
ない胃腸症状が認められた被験者は、1 回のみ減量(15 mg と 12.5 mg を 10 mg に減
量、10 mg 以下をプラセボに変更)することが可能とされ、減量しても忍容できない胃
腸症状が認められる場合は中止することとされた。
有効性の主要評価項目(co-primary endpoints)は、ベースラインから投与 72 週時まで
の体重変化率及び投与 72 週時に 5%以上の体重減少を達成した被験者の割合とされた。
(主な選択基準)
• 20 歳以上
• BMI が 27 kg/m2 以上で 2 つ以上の肥満に関連する健康障害※1 を有する
又は
BMI が 35 kg/m2 以上であり 1 つ以上の肥満に関連する健康障害※1 を有する
※1 肥満に関連する健康障害は、耐糖能異常1)、高トリグリセリド血症2)又は非ア
ルコール性脂肪性肝疾患3)のいずれかとされた
• 体重を減少させるための食事の取組みに 1 回以上失敗している(自己申告)
(主な除外基準)
• 糖尿病の既往歴を有する
(食事療法及び運動療法)
試験期間中、患者には 0、4、8、12、24、36、48、52、60 及び 72 週時に食事・運動
療法のカウンセリングが行われた。
•
食事療法
治験スケジュールに従って、JASSO のガイドラインに基づき、患者は、以下に示
すエネルギー摂取制限と主要栄養素のバランスに焦点をあてた食事のカウンセリ
1) Visit 2(治験薬投与開始 2 週間前、以下同様)で実施する経口グルコース負荷試験(OGTT)の結果、0 時間グルコー
ス値が 110 mg/dL 以上又は 2 時間グルコース値が 140 mg/dL 以上であり、Visit 1(治験薬投与開始 4 週間前、以下同様)
及び Visit 2 において糖尿病の診断基準を満たさない。本治験では、日本の糖尿病診療ガイドライン 2019(J Diabetes
Investig; 2020: 11: 1020-76)の「境界型」に該当する空腹時血糖異常も含まれるよう耐糖能異常が定義された。
2) Visit 1 及び Visit 2 の空腹時トリグリセリドが 150mg/dL 以上である。
3) Visit 2 の MRI プロトン密度脂肪率(中央測定機関による評価)で測定した肝臓脂肪含有率(HFF)が 5%以上である。
4