よむ、つかう、まなぶ。
総-3ー1最適使用推進ガイドライン チルゼパチド [793KB] (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
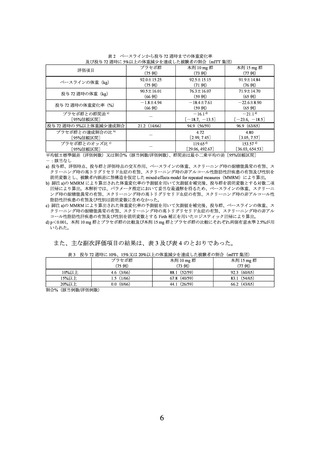
6.投与に際して留意すべき事項
1) 下記の該当する患者については本剤の投与が禁忌とされている。
・ 本剤の成分に対し過敏症の既往歴のある患者
・ 糖尿病性ケトアシドーシス、糖尿病性昏睡又は前昏睡、1 型糖尿病の患者
・ 2 型糖尿病を有する患者における重症感染症、手術等の緊急の場合
2) 妊婦又は妊娠している可能性のある女性には本剤を投与しないこと。妊娠する可
能性のある女性には、本剤投与中及び最終投与後 1 ヵ月間において避妊する必要
性及び適切な避妊法について説明すること。
3) 下記に該当する患者に対する投与の必要性は、慎重に判断すること。
・ 重症胃不全麻痺等の重度の胃腸障害のある患者
・ 膵炎の既往歴のある患者
・ 低血糖を起こすおそれがある以下の患者又は状態
➢ 脳下垂体機能不全又は副腎機能不全
➢ 栄養不良状態、飢餓状態、不規則な食事摂取、食事摂取量の不足又は衰
弱状態
➢ 激しい筋肉運動
➢ 過度のアルコール摂取
・ 増殖糖尿病網膜症、糖尿病黄斑浮腫、急性期治療を要する非増殖糖尿病網膜
症を合併する患者又はこれらの既往歴のある患者
・ 高齢者
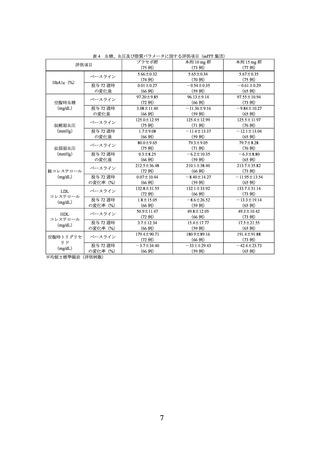
4) 小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
5) 本剤投与中は、甲状腺関連の症候の有無を確認し、異常が認められた場合には、
専門医を受診するよう指導すること。雌雄ラットを用いた 2 年間がん原性試験に
おいて、本剤を 0.15、0.50 及び 1.5 mg/kg の用量(それぞれ臨床最大用量をヒトに
皮下投与した際の AUC の 0.11、0.31 及び 0.88 倍の AUC をもたらす用量)で週 2
回皮下投与したところ、対照群と比較して、甲状腺 C 細胞腫瘍(腺腫及び癌)の
発生頻度の増加がすべての用量でみられた。rasH2 トランスジェニックマウスを
用いた 6 ヵ月間がん原性試験において、本剤を 1、3 及び 10 mg/kg の用量で週 2
回皮下投与したところ、甲状腺 C 細胞の過形成あるいは腫瘍の発生頻度に増加は
認められなかった。甲状腺髄様癌の既往のある患者及び甲状腺髄様癌又は多発性
内分泌腫瘍症 2 型の家族歴のある患者に対する本剤の安全性は確立していない。
6) 急性膵炎が発現することがあるので、急性膵炎の初期症状(嘔吐を伴う持続的な
激しい腹痛等)があらわれた場合は、使用を中止し、速やかに医師の診断を受け
るよう指導すること。
7) 胃腸障害が発現した場合、急性膵炎の可能性を考慮し、必要に応じて画像検査等
による原因精査を考慮するなど、慎重に対応すること。
8) 下痢、嘔吐から脱水を続発し、急性腎障害に至るおそれがあるので、患者の状態
に注意すること。
9) 血圧低下がみられた場合には患者の状態を十分に観察し、異常が認められた場合
には適切な処置を行うこと。
10) 胆石症、胆嚢炎、胆管炎又は胆汁うっ滞性黄疸が発現するおそれがあるので、腹
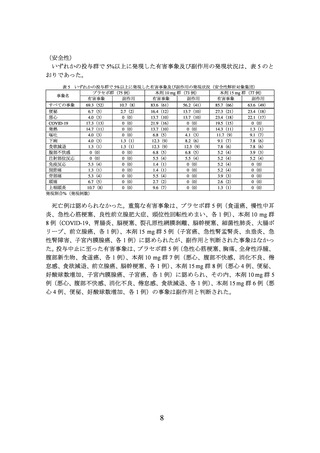
24
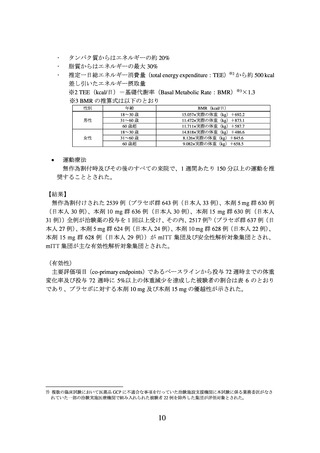
1) 下記の該当する患者については本剤の投与が禁忌とされている。
・ 本剤の成分に対し過敏症の既往歴のある患者
・ 糖尿病性ケトアシドーシス、糖尿病性昏睡又は前昏睡、1 型糖尿病の患者
・ 2 型糖尿病を有する患者における重症感染症、手術等の緊急の場合
2) 妊婦又は妊娠している可能性のある女性には本剤を投与しないこと。妊娠する可
能性のある女性には、本剤投与中及び最終投与後 1 ヵ月間において避妊する必要
性及び適切な避妊法について説明すること。
3) 下記に該当する患者に対する投与の必要性は、慎重に判断すること。
・ 重症胃不全麻痺等の重度の胃腸障害のある患者
・ 膵炎の既往歴のある患者
・ 低血糖を起こすおそれがある以下の患者又は状態
➢ 脳下垂体機能不全又は副腎機能不全
➢ 栄養不良状態、飢餓状態、不規則な食事摂取、食事摂取量の不足又は衰
弱状態
➢ 激しい筋肉運動
➢ 過度のアルコール摂取
・ 増殖糖尿病網膜症、糖尿病黄斑浮腫、急性期治療を要する非増殖糖尿病網膜
症を合併する患者又はこれらの既往歴のある患者
・ 高齢者
4) 小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
5) 本剤投与中は、甲状腺関連の症候の有無を確認し、異常が認められた場合には、
専門医を受診するよう指導すること。雌雄ラットを用いた 2 年間がん原性試験に
おいて、本剤を 0.15、0.50 及び 1.5 mg/kg の用量(それぞれ臨床最大用量をヒトに
皮下投与した際の AUC の 0.11、0.31 及び 0.88 倍の AUC をもたらす用量)で週 2
回皮下投与したところ、対照群と比較して、甲状腺 C 細胞腫瘍(腺腫及び癌)の
発生頻度の増加がすべての用量でみられた。rasH2 トランスジェニックマウスを
用いた 6 ヵ月間がん原性試験において、本剤を 1、3 及び 10 mg/kg の用量で週 2
回皮下投与したところ、甲状腺 C 細胞の過形成あるいは腫瘍の発生頻度に増加は
認められなかった。甲状腺髄様癌の既往のある患者及び甲状腺髄様癌又は多発性
内分泌腫瘍症 2 型の家族歴のある患者に対する本剤の安全性は確立していない。
6) 急性膵炎が発現することがあるので、急性膵炎の初期症状(嘔吐を伴う持続的な
激しい腹痛等)があらわれた場合は、使用を中止し、速やかに医師の診断を受け
るよう指導すること。
7) 胃腸障害が発現した場合、急性膵炎の可能性を考慮し、必要に応じて画像検査等
による原因精査を考慮するなど、慎重に対応すること。
8) 下痢、嘔吐から脱水を続発し、急性腎障害に至るおそれがあるので、患者の状態
に注意すること。
9) 血圧低下がみられた場合には患者の状態を十分に観察し、異常が認められた場合
には適切な処置を行うこと。
10) 胆石症、胆嚢炎、胆管炎又は胆汁うっ滞性黄疸が発現するおそれがあるので、腹
24