よむ、つかう、まなぶ。
資料2-3 TERMS 改訂案 第8版_新旧対照表 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25755.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第4回 5/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
タブレット版TERMS・TERMS新旧対照表
TERMS
ページ
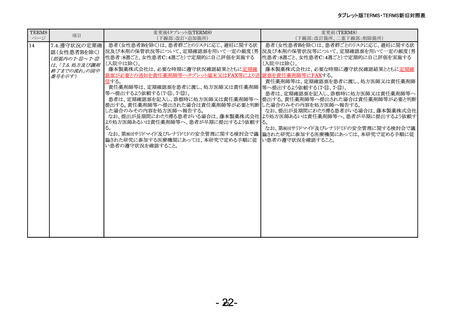
項目
変更後(タブレット版TERMS)
(下線部:改訂・追加箇所)
変更前(TERMS)
(下線部:改訂箇所、二重下線部:削除箇所)
サリドマイドは、1950年代後半に催眠鎮静薬としてドイツで開発された薬
剤であり、本邦においても催眠鎮静薬や胃腸薬として広く使用され、また、
つわり止めとしても処方された。しかし、サリドマイドを妊娠中に服用した場
合、胎児への重大な障害や死産を引き起こすことが明らかとなり、販売の
中止と回収が行われた。
このように、サリドマイドは医薬品市場から撤退したにもかかわらず、その
後も薬効の研究は続けられ、1998年に米国FDAはらい性結節性紅斑を
適応症として厳重な管理システムのもとにサリドマイドの使用を承認した。ま
た、1999年に多発性骨髄腫に対する有効性が米国で報告される等、その
開発が国際的に続けられている。現在、米国、オーストラリア、ニュージー
ランド、EU等で厳格な安全管理のもとでの使用を条件に承認されている。
本邦では、2000年ごろよりサリドマイドの個人輸入量が増加傾向にあり、
関係学会によって安全管理のためのガイドラインが作成され、その周知徹
底が図られた。なお、本邦の多発性骨髄腫患者約14,000人のうち800人
程度の患者が個人輸入薬により治療を受けていると推定された(サリドマイ
ドの輸入量から算出)。また、薬監証明を受けて個人輸入を行っている病
院等の施設は、2007年度において300施設弱であった。
このような状況のもと、藤本製薬株式会社は、サリドマイド製剤(サレドカ
プセル)の製造販売開始にあたり、本邦の医療現場にあった安全管理手
順が必要と考え、関係者の意見を伺いながら、情報提供及び教育、登録、
中央一元管理、評価を重要な構成要素とする本手順を作成した。
サリドマイド製剤(サレドカプセル)が2008年10月に「再発又は難治性の
多発性骨髄腫」の治療薬として承認を受けて以来、本手順の実施状況等
の調査結果を踏まえ、患者の治療アクセスを阻害せずに胎児曝露を防止
するという観点から、必要な改訂を行ってきた。
2012年5月には「らい性結節性紅斑」の効能・効果の追加承認による改
訂を行い、さらに2021年2月に「クロウ・深瀬(POEMS)症候群」の効能・効
果の追加承認を取得したことから、改訂を行った。
1
1.背景
サリドマイドは、1950年代後半に催眠鎮静薬としてドイツで開発された薬
剤であり、本邦においても催眠鎮静薬や胃腸薬として広く使用され、また、
つわり止めとしても処方された。しかし、サリドマイドを妊娠中に服用した場
合、胎児への重大な障害や死産を引き起こすことが明らかとなり、販売の
中止と回収が行われた。
このように、サリドマイドは医薬品市場から撤退したにもかかわらず、その
後も薬効の研究は続けられ、1998年に米国FDAはらい性結節性紅斑を
適応症として厳重な管理システムのもとにサリドマイドの使用を承認した。ま
た、1999年に多発性骨髄腫に対する有効性が米国で報告される等、その
開発が国際的に続けられている。現在、米国、オーストラリア、ニュージー
ランド、EU等で厳格な安全管理のもとでの使用を条件に承認されている。
本邦では、2000年ごろよりサリドマイドの個人輸入量が増加傾向にあり、
関係学会によって安全管理のためのガイドラインが作成され、その周知徹
底が図られた。なお、本邦の多発性骨髄腫患者約14,000人のうち800人
程度の患者が個人輸入薬により治療を受けていると推定された(サリドマイ
ドの輸入量から算出)。また、薬監証明を受けて個人輸入を行っている病
院等の施設は、2007年度において300施設弱であった。
このような状況のもと、藤本製薬株式会社は、サリドマイド製剤(サレドカ
プセル)の製造販売開始にあたり、本邦の医療現場にあった安全管理手
順が必要と考え、関係者の意見を伺いながら、情報提供及び教育、登録、
中央一元管理、評価を重要な構成要素とする本手順を作成した。
サリドマイド製剤(サレドカプセル)が2008年10月に「再発又は難治性の
多発性骨髄腫」の治療薬として承認を受けて以来、本手順の実施状況等
の調査結果を踏まえ、患者の治療アクセスを阻害せずに胎児曝露を防止
するという観点から、必要な改訂を行ってきた。
2012年5月には「らい性結節性紅斑」の効能・効果の追加承認による改
訂を行い、さらに2021年2月に「クロウ・深瀬(POEMS)症候群」の効能・効
果の追加承認を取得したことから、改訂を行った。
202Y年M月に医療現場の利便性を図るためにタブレット端末を追加導
入したことにより、改訂を行った。
1
2.目的
本手順は、藤本製薬株式会社が製造販売承認を受けたサリドマイド製剤 本手順は、藤本製薬株式会社が製造販売承認を受けたサリドマイド製剤
(サレドカプセル;以下、「本剤」という)を厳格に管理し、併せてこの厳格な (サレドカプセル;以下、「本剤」という)を厳格に管理し、併せてこの厳格な
管理を基盤とした本剤の適正な使用を推進し、本剤の胎児への曝露を防 管理を基盤とした本剤の適正な使用を推進し、本剤の胎児への曝露を防
止することを目的とする。
止することを目的とする。
- 44-
TERMS
ページ
項目
変更後(タブレット版TERMS)
(下線部:改訂・追加箇所)
変更前(TERMS)
(下線部:改訂箇所、二重下線部:削除箇所)
サリドマイドは、1950年代後半に催眠鎮静薬としてドイツで開発された薬
剤であり、本邦においても催眠鎮静薬や胃腸薬として広く使用され、また、
つわり止めとしても処方された。しかし、サリドマイドを妊娠中に服用した場
合、胎児への重大な障害や死産を引き起こすことが明らかとなり、販売の
中止と回収が行われた。
このように、サリドマイドは医薬品市場から撤退したにもかかわらず、その
後も薬効の研究は続けられ、1998年に米国FDAはらい性結節性紅斑を
適応症として厳重な管理システムのもとにサリドマイドの使用を承認した。ま
た、1999年に多発性骨髄腫に対する有効性が米国で報告される等、その
開発が国際的に続けられている。現在、米国、オーストラリア、ニュージー
ランド、EU等で厳格な安全管理のもとでの使用を条件に承認されている。
本邦では、2000年ごろよりサリドマイドの個人輸入量が増加傾向にあり、
関係学会によって安全管理のためのガイドラインが作成され、その周知徹
底が図られた。なお、本邦の多発性骨髄腫患者約14,000人のうち800人
程度の患者が個人輸入薬により治療を受けていると推定された(サリドマイ
ドの輸入量から算出)。また、薬監証明を受けて個人輸入を行っている病
院等の施設は、2007年度において300施設弱であった。
このような状況のもと、藤本製薬株式会社は、サリドマイド製剤(サレドカ
プセル)の製造販売開始にあたり、本邦の医療現場にあった安全管理手
順が必要と考え、関係者の意見を伺いながら、情報提供及び教育、登録、
中央一元管理、評価を重要な構成要素とする本手順を作成した。
サリドマイド製剤(サレドカプセル)が2008年10月に「再発又は難治性の
多発性骨髄腫」の治療薬として承認を受けて以来、本手順の実施状況等
の調査結果を踏まえ、患者の治療アクセスを阻害せずに胎児曝露を防止
するという観点から、必要な改訂を行ってきた。
2012年5月には「らい性結節性紅斑」の効能・効果の追加承認による改
訂を行い、さらに2021年2月に「クロウ・深瀬(POEMS)症候群」の効能・効
果の追加承認を取得したことから、改訂を行った。
1
1.背景
サリドマイドは、1950年代後半に催眠鎮静薬としてドイツで開発された薬
剤であり、本邦においても催眠鎮静薬や胃腸薬として広く使用され、また、
つわり止めとしても処方された。しかし、サリドマイドを妊娠中に服用した場
合、胎児への重大な障害や死産を引き起こすことが明らかとなり、販売の
中止と回収が行われた。
このように、サリドマイドは医薬品市場から撤退したにもかかわらず、その
後も薬効の研究は続けられ、1998年に米国FDAはらい性結節性紅斑を
適応症として厳重な管理システムのもとにサリドマイドの使用を承認した。ま
た、1999年に多発性骨髄腫に対する有効性が米国で報告される等、その
開発が国際的に続けられている。現在、米国、オーストラリア、ニュージー
ランド、EU等で厳格な安全管理のもとでの使用を条件に承認されている。
本邦では、2000年ごろよりサリドマイドの個人輸入量が増加傾向にあり、
関係学会によって安全管理のためのガイドラインが作成され、その周知徹
底が図られた。なお、本邦の多発性骨髄腫患者約14,000人のうち800人
程度の患者が個人輸入薬により治療を受けていると推定された(サリドマイ
ドの輸入量から算出)。また、薬監証明を受けて個人輸入を行っている病
院等の施設は、2007年度において300施設弱であった。
このような状況のもと、藤本製薬株式会社は、サリドマイド製剤(サレドカ
プセル)の製造販売開始にあたり、本邦の医療現場にあった安全管理手
順が必要と考え、関係者の意見を伺いながら、情報提供及び教育、登録、
中央一元管理、評価を重要な構成要素とする本手順を作成した。
サリドマイド製剤(サレドカプセル)が2008年10月に「再発又は難治性の
多発性骨髄腫」の治療薬として承認を受けて以来、本手順の実施状況等
の調査結果を踏まえ、患者の治療アクセスを阻害せずに胎児曝露を防止
するという観点から、必要な改訂を行ってきた。
2012年5月には「らい性結節性紅斑」の効能・効果の追加承認による改
訂を行い、さらに2021年2月に「クロウ・深瀬(POEMS)症候群」の効能・効
果の追加承認を取得したことから、改訂を行った。
202Y年M月に医療現場の利便性を図るためにタブレット端末を追加導
入したことにより、改訂を行った。
1
2.目的
本手順は、藤本製薬株式会社が製造販売承認を受けたサリドマイド製剤 本手順は、藤本製薬株式会社が製造販売承認を受けたサリドマイド製剤
(サレドカプセル;以下、「本剤」という)を厳格に管理し、併せてこの厳格な (サレドカプセル;以下、「本剤」という)を厳格に管理し、併せてこの厳格な
管理を基盤とした本剤の適正な使用を推進し、本剤の胎児への曝露を防 管理を基盤とした本剤の適正な使用を推進し、本剤の胎児への曝露を防
止することを目的とする。
止することを目的とする。
- 44-