よむ、つかう、まなぶ。
資料1-2 調査結果報告書 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27607.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第10回) |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
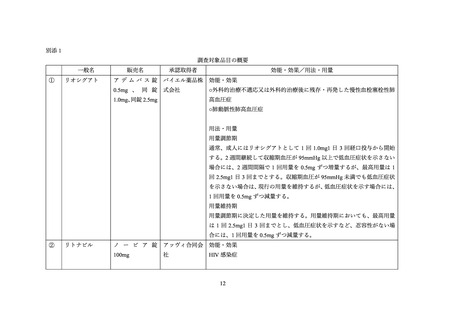
また、複数の専門委員より、リトナビル含有製剤又はアタザナビルとリオシグアトの併
用時の注意事項として「1 回 1.0 mg、1 日 3 回より低用量からの開始も考慮する」という表
現は分かりにくく、医療現場で誤解を招く可能性があるため、リオシグアトの添付文書に記
載する注意事項には「1 回 0.5mg、1 日 3 回」という情報を記載することが望ましいという
意見が出された。
機構は、上記の意見を踏まえ、リオシグアトの添付文書における当該注意事項について
は、1 回 0.5mg、1 日 3 回からの開始も考慮する旨を明確することが適切と考える。なお、
リオシグアトの審査報告書において、腎機能障害患者(クレアチニン・クリアランス 15 以
上 80 mL/min 未満)については、腎機能正常被験者に比べリオシグアトの AUC が約 2 倍程
度増加することが認められていること等から 1 回 0.5 mg、1 日 3 回から開始することも考慮
することが望ましいとされていることを踏まえると、添付文書における腎機能障害患者へ
の注意事項も 1 回 0.5mg、1 日 3 回からの開始も考慮する旨を明確にすることが適切と考え
る。
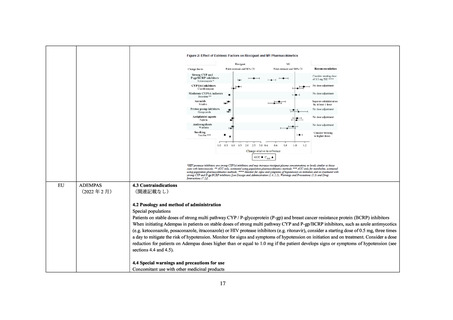
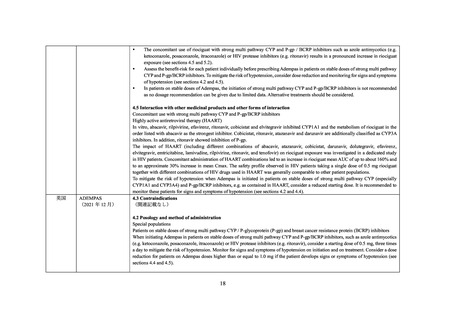
なお、リルピビリン、コビシスタット及びアバカビルを併用注意とするという機構の判
断について、一部の委員より、アバカビルではリオシグアトの曝露量が約 2.5 倍増加してい
ることも踏まえるとリオシグアトとアバカビルを併用禁忌とする必要がないか検討すべき
との意見が出された。
当該意見を踏まえ、機構はリオシグアトとアバカビルを併用禁忌とする必要性について
検討を行った。アバカビルではリオシグアトの曝露量が約 2.5 倍増加していることを考慮す
ると、アバカビル投与中の患者でリオシグアトを通常の開始用量より低用量(1 回 0.5 mg、
1 日 3 回)で開始した場合であっても、その曝露量はアバカビル非投与患者で通常の開始用
量(1 回 1 mg、1 日 3 回)で開始した場合の曝露量を上回ることが予想される。しかしなが
ら、国内外でリオシグアトとアバカビルの併用は禁忌とされていないが有害事象報告、公表
文献等において当該併用に関して特段の問題は確認できなかったこと、17957 試験において
リオシグアトとアバカビルの併用時の安全性に特段の問題は認められていないことを踏ま
えると、併用禁忌とする必要性は低いと考える。ただし、17957 試験においてリオシグアト
とアバカビルの併用に関する検討例数が少数であることを考慮すると、アバカビルを含め
た抗 HIV 薬とリオシグアト併用時の安全性について引き続き情報収集を行い、追加の措置
の要否を検討することが適切と考える。
Ⅵ.総合評価
機構は、以上の検討を踏まえ別添 4 に示すとおり添付文書の使用上の注意を改訂して差
し支えないと判断した。
11
用時の注意事項として「1 回 1.0 mg、1 日 3 回より低用量からの開始も考慮する」という表
現は分かりにくく、医療現場で誤解を招く可能性があるため、リオシグアトの添付文書に記
載する注意事項には「1 回 0.5mg、1 日 3 回」という情報を記載することが望ましいという
意見が出された。
機構は、上記の意見を踏まえ、リオシグアトの添付文書における当該注意事項について
は、1 回 0.5mg、1 日 3 回からの開始も考慮する旨を明確することが適切と考える。なお、
リオシグアトの審査報告書において、腎機能障害患者(クレアチニン・クリアランス 15 以
上 80 mL/min 未満)については、腎機能正常被験者に比べリオシグアトの AUC が約 2 倍程
度増加することが認められていること等から 1 回 0.5 mg、1 日 3 回から開始することも考慮
することが望ましいとされていることを踏まえると、添付文書における腎機能障害患者へ
の注意事項も 1 回 0.5mg、1 日 3 回からの開始も考慮する旨を明確にすることが適切と考え
る。
なお、リルピビリン、コビシスタット及びアバカビルを併用注意とするという機構の判
断について、一部の委員より、アバカビルではリオシグアトの曝露量が約 2.5 倍増加してい
ることも踏まえるとリオシグアトとアバカビルを併用禁忌とする必要がないか検討すべき
との意見が出された。
当該意見を踏まえ、機構はリオシグアトとアバカビルを併用禁忌とする必要性について
検討を行った。アバカビルではリオシグアトの曝露量が約 2.5 倍増加していることを考慮す
ると、アバカビル投与中の患者でリオシグアトを通常の開始用量より低用量(1 回 0.5 mg、
1 日 3 回)で開始した場合であっても、その曝露量はアバカビル非投与患者で通常の開始用
量(1 回 1 mg、1 日 3 回)で開始した場合の曝露量を上回ることが予想される。しかしなが
ら、国内外でリオシグアトとアバカビルの併用は禁忌とされていないが有害事象報告、公表
文献等において当該併用に関して特段の問題は確認できなかったこと、17957 試験において
リオシグアトとアバカビルの併用時の安全性に特段の問題は認められていないことを踏ま
えると、併用禁忌とする必要性は低いと考える。ただし、17957 試験においてリオシグアト
とアバカビルの併用に関する検討例数が少数であることを考慮すると、アバカビルを含め
た抗 HIV 薬とリオシグアト併用時の安全性について引き続き情報収集を行い、追加の措置
の要否を検討することが適切と考える。
Ⅵ.総合評価
機構は、以上の検討を踏まえ別添 4 に示すとおり添付文書の使用上の注意を改訂して差
し支えないと判断した。
11