よむ、つかう、まなぶ。
【資料5】医薬・生活衛生局からの定期報告 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
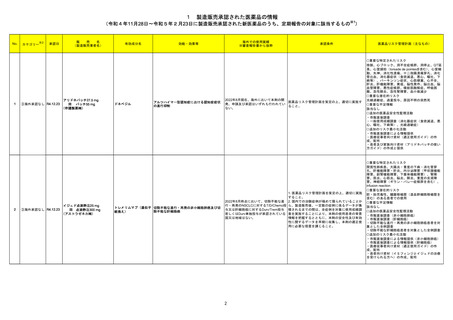
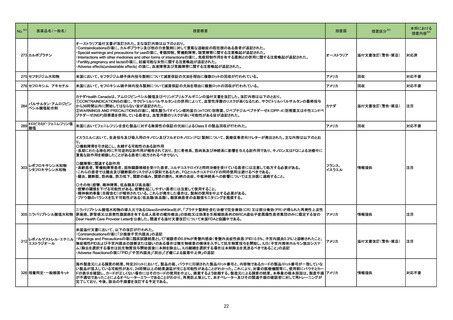
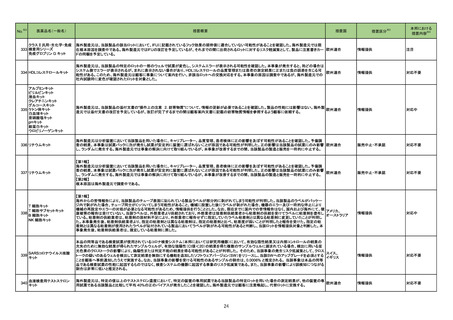
3 外国での新たな措置の報告状況 ※1
(令和4年8月1日~令和4年11月30日)
※2
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
1 アシクロビル
カナダにおいて、Apotex Inc.のアシクロビル錠(力価200mgおよび800mg)の特定ロットについて、許容レベルを超えるニトロソアミン不純物が含まれるとして回
カナダ
収されている。
回収
対応不要
2 デクスメデトミジン塩酸塩
アイルランドHPRAのHPに、デクスメデトミジンの医療専門家向けレターが掲載された。概要は以下のとおり。
・SPICE III試験は、機械的人工呼吸を必要とする集中治療室の重症成人患者3,904名を対象にデクスメデトミジンによる鎮静の影響を標準治療の影響と比較
した無作為化臨床試験である。
・デクスメデトミジン治療群と標準治療群の90日全死因死亡率に差は認められなかった。
・患者のうち、65歳以下の年齢層ではデクスメデトミジン群は標準治療群より死亡リスクが高い結果であったが、機序は不明。
アイルランド
・65歳以下の患者の死亡率に対する影響は、術後ケア以外の理由で入院した患者投与したケースで最も顕著に現れ、APACHEⅡスコアの増加とともに増大し
た。
・若年患者においては、臨床的有用性を他の鎮静剤と比較検討すべきである。
・添付文書に65歳以下のICU患者の死亡率増加に関する記載が追記される予定である。
情報提供
対応中
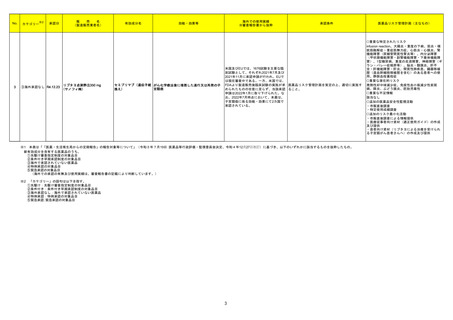
3 アミオダロン塩酸塩
英国MHRAはhameln pharma ltd,社製のアミオダロン塩酸塩濃縮液50mg/mlの1ロットで再検査中に溶液内の目視可能な結晶粒子の増加が確認されたため、
イギリス
予防措置としてクラス2の自主回収されたことを公表した。
回収
対応不要
4 オラパリブ
治験責任医師宛に情報が発出された。主な内容は以下のとおり。
・一次導入療法後に進行が認められていない切除不能又は転移性結腸・直腸癌患者を対象としたオラパリブ単独投与又はベバシズマブとの併用投与の有効性
及び安全性を標準治療(ベバシズマブ+フッ化ピリミジン系製剤)と比較して評価する第Ⅲ相無作為化非盲検試験の無増悪生存期間の中間解析について、標 アメリカ
準治療群に対するオラパリブ単独投与及びオラパリブとベバシズマブ併用投与での有効性が、独立した外部データモニタリング委員会による無益性の基準を満
たしていると判断されたため、両投与群が中止されることが決定された。
情報提供
対応不要
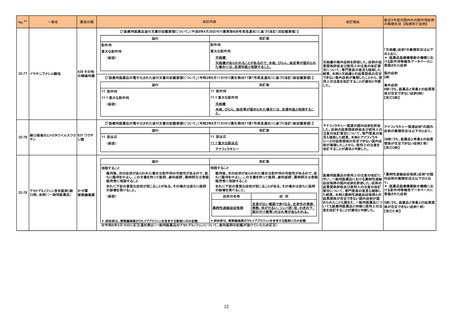
7 アシクロビル
シンガポールにおいて、アシクロビル800mg錠の特定ロットについて、許容レベルを超えるニトロソアミン不純物が含まれるとして回収されている。
回収
対応不要
回収
対応不要
情報提供
対応済
添付文書改訂(警告・禁忌)
対応不要
15
シンガポール
精製ヒアルロン酸ナトリウム
精製ヒアルロン酸ナトリウム・ ドイツにおいて、ヒアルロン酸ナトリウム眼粘弾剤製品の滅菌工程に逸脱が確認され、製品の無菌性が保証されないため、期限切れでない製品を対象として回
ドイツ
コンドロイチン硫酸エステル 収が行われた。
ナトリウム
スイスにおいて、企業が医療従事者向けのレターを発出し、腎機能障害患者への投与及び他剤との相互作用の可能性について、注意喚起している。主な内容
は以下のとおり。
17 ニルマトレルビル・リトナビル ・重度の腎機能障害患者には使用しないこと、中等度の腎機能障害患者はニルマトレルビルを半量に調整すること
スイス
・本剤はCYP3A阻害剤であり主にCYP3Aを介して代謝される薬剤の血漿中濃度を上昇させる可能性があること、CYP3A阻害剤/誘導剤投与時に本剤の濃度
が増加/減少する可能性があること、相互作用により発現し得る副作用等のリスク、併用禁忌の例
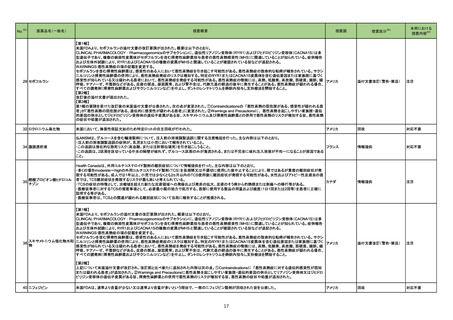
28 ブピバカイン塩酸塩水和物
米国添付文書が改訂された。改訂の概要は以下のとおり。
Contraindications:静脈内局所麻酔(Bier Block)が追記された。
Use in specific populations:
・中等度から重度の肝障害患者に投与する際は、投与量の減量と全身性の副作用のモニターの増加を検討すること
・腎障害患者は有害事象のリスクが増加する可能性がある、投与量を検討すること
・臨床試験において、高齢者では、若年成人患者よりも、最大の痛覚遮断域および最大の運動神経遮断が得られるまでの時間が短かった旨
16
アメリカ
(令和4年8月1日~令和4年11月30日)
※2
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
1 アシクロビル
カナダにおいて、Apotex Inc.のアシクロビル錠(力価200mgおよび800mg)の特定ロットについて、許容レベルを超えるニトロソアミン不純物が含まれるとして回
カナダ
収されている。
回収
対応不要
2 デクスメデトミジン塩酸塩
アイルランドHPRAのHPに、デクスメデトミジンの医療専門家向けレターが掲載された。概要は以下のとおり。
・SPICE III試験は、機械的人工呼吸を必要とする集中治療室の重症成人患者3,904名を対象にデクスメデトミジンによる鎮静の影響を標準治療の影響と比較
した無作為化臨床試験である。
・デクスメデトミジン治療群と標準治療群の90日全死因死亡率に差は認められなかった。
・患者のうち、65歳以下の年齢層ではデクスメデトミジン群は標準治療群より死亡リスクが高い結果であったが、機序は不明。
アイルランド
・65歳以下の患者の死亡率に対する影響は、術後ケア以外の理由で入院した患者投与したケースで最も顕著に現れ、APACHEⅡスコアの増加とともに増大し
た。
・若年患者においては、臨床的有用性を他の鎮静剤と比較検討すべきである。
・添付文書に65歳以下のICU患者の死亡率増加に関する記載が追記される予定である。
情報提供
対応中
3 アミオダロン塩酸塩
英国MHRAはhameln pharma ltd,社製のアミオダロン塩酸塩濃縮液50mg/mlの1ロットで再検査中に溶液内の目視可能な結晶粒子の増加が確認されたため、
イギリス
予防措置としてクラス2の自主回収されたことを公表した。
回収
対応不要
4 オラパリブ
治験責任医師宛に情報が発出された。主な内容は以下のとおり。
・一次導入療法後に進行が認められていない切除不能又は転移性結腸・直腸癌患者を対象としたオラパリブ単独投与又はベバシズマブとの併用投与の有効性
及び安全性を標準治療(ベバシズマブ+フッ化ピリミジン系製剤)と比較して評価する第Ⅲ相無作為化非盲検試験の無増悪生存期間の中間解析について、標 アメリカ
準治療群に対するオラパリブ単独投与及びオラパリブとベバシズマブ併用投与での有効性が、独立した外部データモニタリング委員会による無益性の基準を満
たしていると判断されたため、両投与群が中止されることが決定された。
情報提供
対応不要
7 アシクロビル
シンガポールにおいて、アシクロビル800mg錠の特定ロットについて、許容レベルを超えるニトロソアミン不純物が含まれるとして回収されている。
回収
対応不要
回収
対応不要
情報提供
対応済
添付文書改訂(警告・禁忌)
対応不要
15
シンガポール
精製ヒアルロン酸ナトリウム
精製ヒアルロン酸ナトリウム・ ドイツにおいて、ヒアルロン酸ナトリウム眼粘弾剤製品の滅菌工程に逸脱が確認され、製品の無菌性が保証されないため、期限切れでない製品を対象として回
ドイツ
コンドロイチン硫酸エステル 収が行われた。
ナトリウム
スイスにおいて、企業が医療従事者向けのレターを発出し、腎機能障害患者への投与及び他剤との相互作用の可能性について、注意喚起している。主な内容
は以下のとおり。
17 ニルマトレルビル・リトナビル ・重度の腎機能障害患者には使用しないこと、中等度の腎機能障害患者はニルマトレルビルを半量に調整すること
スイス
・本剤はCYP3A阻害剤であり主にCYP3Aを介して代謝される薬剤の血漿中濃度を上昇させる可能性があること、CYP3A阻害剤/誘導剤投与時に本剤の濃度
が増加/減少する可能性があること、相互作用により発現し得る副作用等のリスク、併用禁忌の例
28 ブピバカイン塩酸塩水和物
米国添付文書が改訂された。改訂の概要は以下のとおり。
Contraindications:静脈内局所麻酔(Bier Block)が追記された。
Use in specific populations:
・中等度から重度の肝障害患者に投与する際は、投与量の減量と全身性の副作用のモニターの増加を検討すること
・腎障害患者は有害事象のリスクが増加する可能性がある、投与量を検討すること
・臨床試験において、高齢者では、若年成人患者よりも、最大の痛覚遮断域および最大の運動神経遮断が得られるまでの時間が短かった旨
16
アメリカ