よむ、つかう、まなぶ。
【資料5】医薬・生活衛生局からの定期報告 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
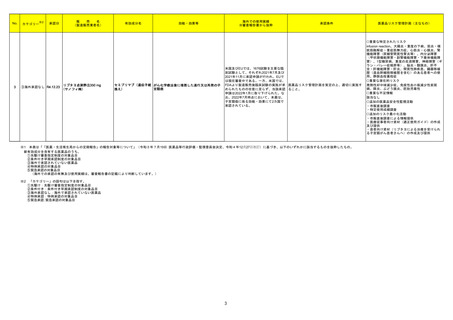
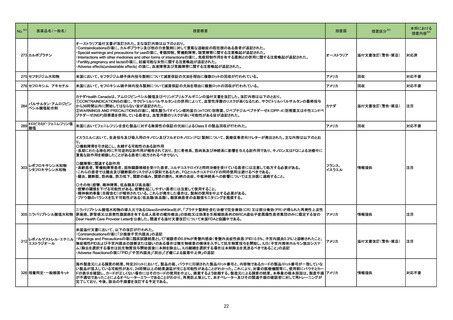
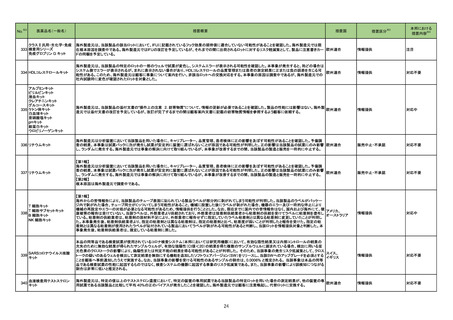
No.※2
医薬品名(一般名)
153 アシクロビル
措置概要
措置区分※3
措置国
米国において、Eugia US LLC社のアシクロビル静注製剤(500mg/10mL)が粒子状物質の混入を理由に回収されている。
本邦における
※4
措置内容
アメリカ
回収
対応不要
欧州連合
添付文書改訂(警告・禁忌)
注目
麻黄附子細辛湯
シンガポールにおいて、麻黄附子細辛湯エキス顆粒(医療用)と一般名が同一である医薬品について、アリストロキア酸が含まれていることが判明したため、小
165 麻黄附子細辛湯含有一般用
シンガポール
売業者および卸売業者に対して影響を受けるバッチの供給を停止し、残りの在庫を製造販売業者に返却するよう、シンガポール当局から指示がなされた。
医薬品
回収
対応不要
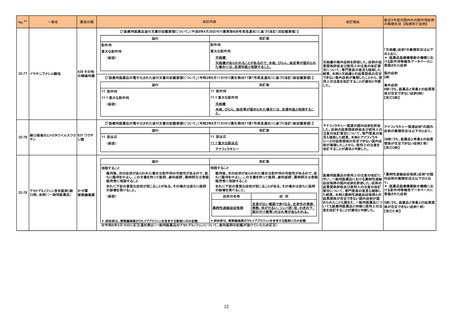
167 ゲムシタビン塩酸塩
韓国において、特定のバイアルが回収された。
回収
対応不要
182 レボフロキサシン水和物
インドネシア添付文書が改訂された。主な改訂内容は以下のとおり。
・米国添付文書を反映して、WARNINGS BOXの項に、フルオロキノロンの重篤副作用には腱炎及び腱断裂、末梢神経障害、中枢神経系への影響が含まれ、
これらの副作用を経験した場合は直ちに投与を中止しフルオロキノロンの使用を避ける旨、重症筋無力症の筋力低下を悪化させる可能性があるので重症筋無
インドネシア
力症の既往歴のある患者は使用を避ける旨を追記。
・米国添付文書を反映して、PRECAUTIONSの項に、フルオロキノロンが腱炎及び腱断裂、末梢神経障害のリスク増加と関連している旨を追記。
・本邦添付文書を反映して、PRECAUTIONSの項に慎重に投与する患者の追記、ADVERSE REACTIONSに複数の事象の追記が行われた。
添付文書改訂(警告・禁忌)
対応済
185 ダサチニブ水和物
オーストラリアにおいて特定のバッチが回収された。
オーストラリア
回収
対応不要
197 ブピバカイン塩酸塩水和物
米国添付文書が改訂された。新たに追記された内容は以下のとおり。
Contraindicationsの項
・ブピバカイン、アミド型局所麻酔薬、本剤の成分に対する過敏症を有する患者
・静脈内局所麻酔(Bierブロック)
アメリカ
添付文書改訂(警告・禁忌)
対応済
198 トラネキサム酸
米国FDAはEnforcement report2022年10月12日号において、AuroMedics Pharma LLC社製のトラネキサム酸製剤において、バイアル製品において粒子状
の金属片が発見されたことから、自主的回収を実施したことが公表された。
アメリカ
回収
対応不要
200 メトロニダゾール
カナダ添付文書が改訂され、CONTRAINDICATIONSの項に、コケイン症候群の患者が追加され、コケイン症候群の患者でメトロニダゾールを開始後に転帰死
カナダ
亡で重篤な非可逆性の肝毒性/急性肝不全が報告されている旨が追記された。
添付文書改訂(警告・禁忌)
注目
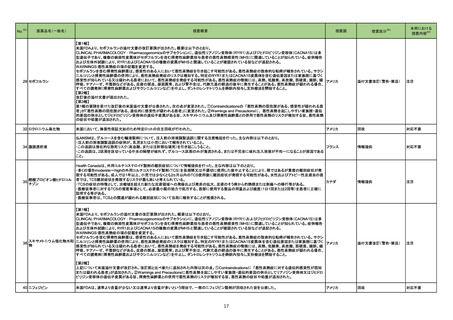
204 セファゾリンナトリウム
中国当局が、セファゾリン注射剤の添付文書の内容を統一するよう公告を発出している。主な内容は以下のとおり。
〇副作用の項には、ヘノッホ・シェーンライン紫斑病、多形紅斑、剥脱性皮膚炎、スティーブンスジョンソン(Stevens-Johnson)症候群、中毒性表皮壊死融解
症、急性汎発性発疹性膿疱症、黄疸、肝炎、偽膜性結腸炎、アナフィラキシー、全身または局所の麻痺、振戦、ひきつけ、痙攣、呼吸困難、胸腔貯留液、気管
支痙攣、間質性肺炎、好酸球性肺炎、心房細動及びその他の不整脈、凝固機能障害、好中球減少症、白血球減少症、血小板減少症、汎血球減少、無顆粒球
症、再生不良性貧血、溶血性貧血、間質性腎炎、腎不全、筋無力症を含まなければならない。
〇禁忌の項には、セファゾリンにアレルギーのある場合、その他のセファロスポリン系にアレルギーのある場合、ペニシリンまたはその他のβ-ラクタム系薬剤
に重篤な過敏症既往歴がある患者を含まなければならない。
中国
〇注意事項の項には、以下を含まなければならない。
・腎機能障害患者に不適切な高用量を投与するとてんかん発作をもたらす可能性があり、腎機能障害または腎機能不全による低尿量患者に適用する場合は
減量する必要がある旨
・クロストリジオイデスディフィシル関連下痢症(CDAD)が報告されており、CDADの発生を確認または疑われる場合は抗生物質の中止が必要となる可能性が
ある旨、同時に臨床での徴候に基づいて適切に処置する旨
・硫酸アミカシン、硫酸カナマイシン、塩酸クロルテトラサイクリン、塩酸オキシテトラサイクリン、塩酸テトラサイクリン、グルコン酸エリスロマイシン、硫酸ポリミキ
シンB、コリスチンメタンスルホン酸ナトリウム、グルコン酸カルシウムとは併用禁忌である旨
添付文書改訂(警告・禁忌)
注目
214 テイコプラニン
英国において、200mg静注製剤の2バッチについて、細菌性エンドトキシンの存在が確認されたとして、自主回収されている。
回収
対応不要
160
レボノルゲストレル・エチニル 欧州EMAにおいて、norelgestromin/エチニルエストラジオールの配合剤の添付文書改訂が通知された。改訂内容は以下のとおり。
エストラジオール
・Contraindications、Special warnings and precautions for use、Interactionの項:グレカプレビル・ピブレンタスビルとの併用に関する情報の修正
ノルエチステロン・エチニルエ
・Special warnings and precautions for use、Undesirable effectsの項:エチニルエストラジオール含有製剤における血管浮腫の更新
ストラジオール
韓国
20
イギリス
医薬品名(一般名)
153 アシクロビル
措置概要
措置区分※3
措置国
米国において、Eugia US LLC社のアシクロビル静注製剤(500mg/10mL)が粒子状物質の混入を理由に回収されている。
本邦における
※4
措置内容
アメリカ
回収
対応不要
欧州連合
添付文書改訂(警告・禁忌)
注目
麻黄附子細辛湯
シンガポールにおいて、麻黄附子細辛湯エキス顆粒(医療用)と一般名が同一である医薬品について、アリストロキア酸が含まれていることが判明したため、小
165 麻黄附子細辛湯含有一般用
シンガポール
売業者および卸売業者に対して影響を受けるバッチの供給を停止し、残りの在庫を製造販売業者に返却するよう、シンガポール当局から指示がなされた。
医薬品
回収
対応不要
167 ゲムシタビン塩酸塩
韓国において、特定のバイアルが回収された。
回収
対応不要
182 レボフロキサシン水和物
インドネシア添付文書が改訂された。主な改訂内容は以下のとおり。
・米国添付文書を反映して、WARNINGS BOXの項に、フルオロキノロンの重篤副作用には腱炎及び腱断裂、末梢神経障害、中枢神経系への影響が含まれ、
これらの副作用を経験した場合は直ちに投与を中止しフルオロキノロンの使用を避ける旨、重症筋無力症の筋力低下を悪化させる可能性があるので重症筋無
インドネシア
力症の既往歴のある患者は使用を避ける旨を追記。
・米国添付文書を反映して、PRECAUTIONSの項に、フルオロキノロンが腱炎及び腱断裂、末梢神経障害のリスク増加と関連している旨を追記。
・本邦添付文書を反映して、PRECAUTIONSの項に慎重に投与する患者の追記、ADVERSE REACTIONSに複数の事象の追記が行われた。
添付文書改訂(警告・禁忌)
対応済
185 ダサチニブ水和物
オーストラリアにおいて特定のバッチが回収された。
オーストラリア
回収
対応不要
197 ブピバカイン塩酸塩水和物
米国添付文書が改訂された。新たに追記された内容は以下のとおり。
Contraindicationsの項
・ブピバカイン、アミド型局所麻酔薬、本剤の成分に対する過敏症を有する患者
・静脈内局所麻酔(Bierブロック)
アメリカ
添付文書改訂(警告・禁忌)
対応済
198 トラネキサム酸
米国FDAはEnforcement report2022年10月12日号において、AuroMedics Pharma LLC社製のトラネキサム酸製剤において、バイアル製品において粒子状
の金属片が発見されたことから、自主的回収を実施したことが公表された。
アメリカ
回収
対応不要
200 メトロニダゾール
カナダ添付文書が改訂され、CONTRAINDICATIONSの項に、コケイン症候群の患者が追加され、コケイン症候群の患者でメトロニダゾールを開始後に転帰死
カナダ
亡で重篤な非可逆性の肝毒性/急性肝不全が報告されている旨が追記された。
添付文書改訂(警告・禁忌)
注目
204 セファゾリンナトリウム
中国当局が、セファゾリン注射剤の添付文書の内容を統一するよう公告を発出している。主な内容は以下のとおり。
〇副作用の項には、ヘノッホ・シェーンライン紫斑病、多形紅斑、剥脱性皮膚炎、スティーブンスジョンソン(Stevens-Johnson)症候群、中毒性表皮壊死融解
症、急性汎発性発疹性膿疱症、黄疸、肝炎、偽膜性結腸炎、アナフィラキシー、全身または局所の麻痺、振戦、ひきつけ、痙攣、呼吸困難、胸腔貯留液、気管
支痙攣、間質性肺炎、好酸球性肺炎、心房細動及びその他の不整脈、凝固機能障害、好中球減少症、白血球減少症、血小板減少症、汎血球減少、無顆粒球
症、再生不良性貧血、溶血性貧血、間質性腎炎、腎不全、筋無力症を含まなければならない。
〇禁忌の項には、セファゾリンにアレルギーのある場合、その他のセファロスポリン系にアレルギーのある場合、ペニシリンまたはその他のβ-ラクタム系薬剤
に重篤な過敏症既往歴がある患者を含まなければならない。
中国
〇注意事項の項には、以下を含まなければならない。
・腎機能障害患者に不適切な高用量を投与するとてんかん発作をもたらす可能性があり、腎機能障害または腎機能不全による低尿量患者に適用する場合は
減量する必要がある旨
・クロストリジオイデスディフィシル関連下痢症(CDAD)が報告されており、CDADの発生を確認または疑われる場合は抗生物質の中止が必要となる可能性が
ある旨、同時に臨床での徴候に基づいて適切に処置する旨
・硫酸アミカシン、硫酸カナマイシン、塩酸クロルテトラサイクリン、塩酸オキシテトラサイクリン、塩酸テトラサイクリン、グルコン酸エリスロマイシン、硫酸ポリミキ
シンB、コリスチンメタンスルホン酸ナトリウム、グルコン酸カルシウムとは併用禁忌である旨
添付文書改訂(警告・禁忌)
注目
214 テイコプラニン
英国において、200mg静注製剤の2バッチについて、細菌性エンドトキシンの存在が確認されたとして、自主回収されている。
回収
対応不要
160
レボノルゲストレル・エチニル 欧州EMAにおいて、norelgestromin/エチニルエストラジオールの配合剤の添付文書改訂が通知された。改訂内容は以下のとおり。
エストラジオール
・Contraindications、Special warnings and precautions for use、Interactionの項:グレカプレビル・ピブレンタスビルとの併用に関する情報の修正
ノルエチステロン・エチニルエ
・Special warnings and precautions for use、Undesirable effectsの項:エチニルエストラジオール含有製剤における血管浮腫の更新
ストラジオール
韓国
20
イギリス