よむ、つかう、まなぶ。
【資料5】医薬・生活衛生局からの定期報告 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
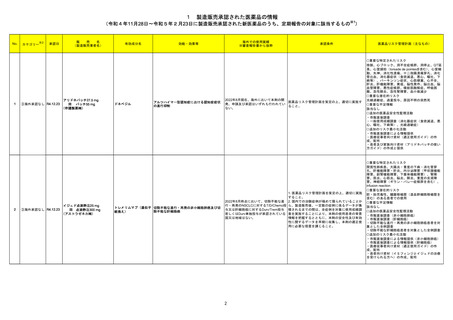
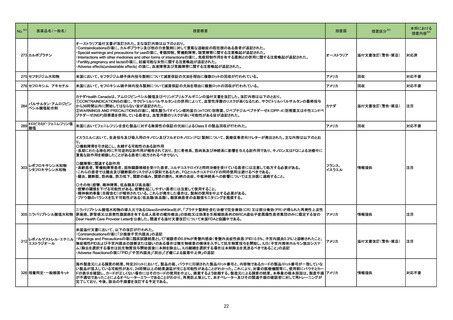
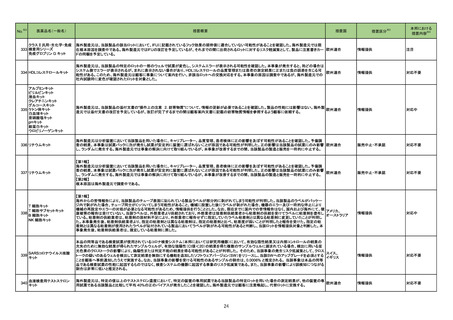
No.
3
カテゴリー
※2
承認日
③海外承認なし R4.12.23
販
売
名
(製造販売業者名)
リブタヨ点滴静注350 mg
(サノフィ㈱)
有効成分名
海外での使用実績
※審査報告書から抜粋
効能・効果等
セミプリマブ(遺伝子組 がん化学療法後に増悪した進行又は再発の子
宮頸癌
換え)
承認条件
米国及びEUでは、1676試験を主要な臨
床試験として、それぞれ2021年7月及び
2021年11月に承認申請が行われ、EUで
は現在審査中である。一方、米国では、
FDAより製造販売後臨床試験の実施が求 医薬品リスク管理計画を策定の上、適切に実施す
められたものの合意に至らず、当該承認 ること。
申請は2022年1月に取り下げられた。な
お、2022年7月時点において、本薬は、
子宮頸癌に係る効能・効果にて2カ国で
承認されている。
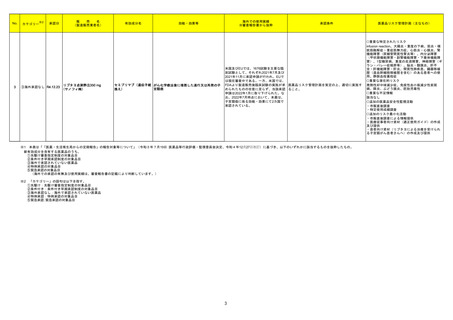
※1 本表は「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定、令和4年12月27日改訂)に基づき、以下のいずれかに該当するものを抜粋したもの。
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
3
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
infusion reaction、大腸炎・重度の下痢、筋炎・横
紋筋融解症・重症筋無力症、心筋炎・心膜炎、腎
機能障害(尿細管間質性腎炎等)、内分泌障害
(甲状腺機能障害・副腎機能障害・下垂体機能障
害)、1型糖尿病、重度の皮膚障害、神経障害(ギ
ラン・バレー症候群等)、脳炎・髄膜炎、肝不
全・肝機能障害・肝炎、間質性肺疾患、臓器移植
歴(造血幹細胞移植歴を含む)のある患者への使
用、静脈血栓塞栓症
○重要な潜在的リスク
発熱性好中球減少症、免疫性血小板減少性紫斑
病、膵炎、ぶどう膜炎、胚胎児毒性
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成
及び提供
・患者向け資材(リブタヨによる治療を受けられ
る子宮頸がん患者さんへ)の作成及び提供
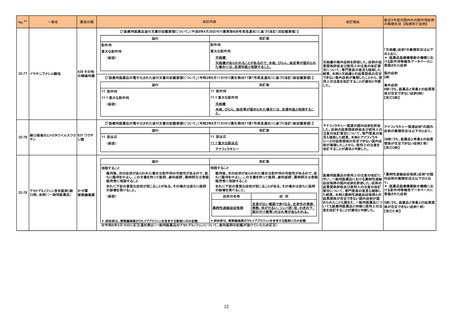
3
カテゴリー
※2
承認日
③海外承認なし R4.12.23
販
売
名
(製造販売業者名)
リブタヨ点滴静注350 mg
(サノフィ㈱)
有効成分名
海外での使用実績
※審査報告書から抜粋
効能・効果等
セミプリマブ(遺伝子組 がん化学療法後に増悪した進行又は再発の子
宮頸癌
換え)
承認条件
米国及びEUでは、1676試験を主要な臨
床試験として、それぞれ2021年7月及び
2021年11月に承認申請が行われ、EUで
は現在審査中である。一方、米国では、
FDAより製造販売後臨床試験の実施が求 医薬品リスク管理計画を策定の上、適切に実施す
められたものの合意に至らず、当該承認 ること。
申請は2022年1月に取り下げられた。な
お、2022年7月時点において、本薬は、
子宮頸癌に係る効能・効果にて2カ国で
承認されている。
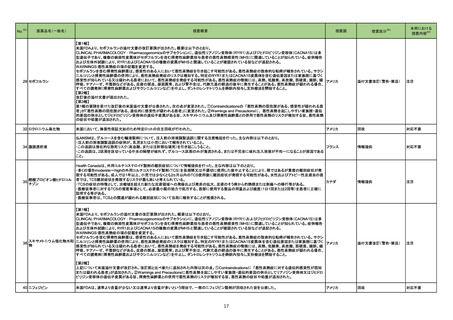
※1 本表は「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定、令和4年12月27日改訂)に基づき、以下のいずれかに該当するものを抜粋したもの。
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
3
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
infusion reaction、大腸炎・重度の下痢、筋炎・横
紋筋融解症・重症筋無力症、心筋炎・心膜炎、腎
機能障害(尿細管間質性腎炎等)、内分泌障害
(甲状腺機能障害・副腎機能障害・下垂体機能障
害)、1型糖尿病、重度の皮膚障害、神経障害(ギ
ラン・バレー症候群等)、脳炎・髄膜炎、肝不
全・肝機能障害・肝炎、間質性肺疾患、臓器移植
歴(造血幹細胞移植歴を含む)のある患者への使
用、静脈血栓塞栓症
○重要な潜在的リスク
発熱性好中球減少症、免疫性血小板減少性紫斑
病、膵炎、ぶどう膜炎、胚胎児毒性
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成
及び提供
・患者向け資材(リブタヨによる治療を受けられ
る子宮頸がん患者さんへ)の作成及び提供