よむ、つかう、まなぶ。
【資料5】医薬・生活衛生局からの定期報告 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
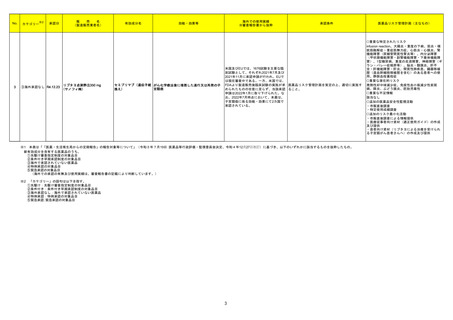
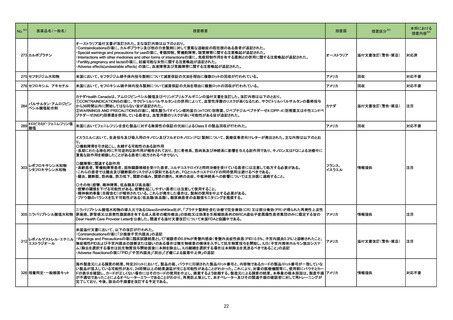
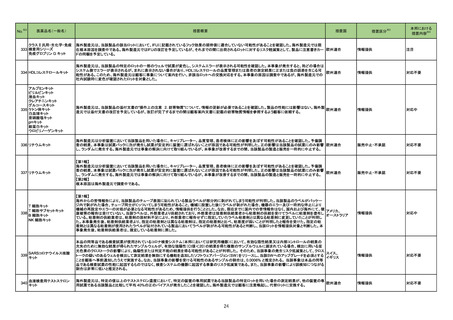
No.※2
47
医薬品名(一般名)
措置概要
措置区分※3
措置国
治験責任医師宛てに情報が発出された。主な内容は以下のとおり。
ペムブロリズマブ(遺伝子組 ・新規ホルモン剤(アビラテロン酢酸エステル及びエンザルタミド等)による治療後に進行した転移性去勢抵抗性前立腺癌(mCRPC)の化学療法未治療患者を
換え)
対象とした二重盲検無作為化第Ⅲ相試験において、二つの主要評価項目の一つである全生存期間について、本剤、ドセタキセル及びプレドニゾロンの併用投
与の有効性が示されなかった。
アメリカ
本邦における
※4
措置内容
情報提供
対応不要
48 メキシレチン塩酸塩
英国MHRAはClinigen Healthcare Ltdがメキシレチン塩酸塩 50mg、100mg、および 200mg 硬カプセル剤の安定性試験において充填量の適正範囲から逸脱
の可能性が確認されたことを受けて、過少量投与又は過量投与の潜在的リスクがあるとして、これらの製剤の3 つのバッチについて回収を開始したことを公表し イギリス
た。
回収
対応不要
サルブタモール硫酸塩
フルチカゾンプロピオン酸エ
ステル
50
サルメテロールキシナホ酸
塩・フルチカゾンプロピオン酸
エステル
デンマークにおけるディスカス製剤のデバイス組み立てラインでのプラスチック片発生に伴う外部リコールの告知。
プラスチック片はデバイス内のパーツの破損に由来し、デバイス組み立て装置の設定不良により発生したものであると考えられた。デバイスの構造上、プラス
チック片がデバイスの吸入口に来ることはないため、患者へのリスクはなく、ディスカス自体の機能に与えるリスクも十分に低いことが確認された。
デンマーク
デンマーク医薬品庁はベントリンの1バッチの外部回収し、デンマーク市場向けFlixotideの第2バッチも内部回収の予定である。スイス、ニュージーランド、ポルト
ガルの各市場でも1バッチの内部回収が実施される予定である。
回収
対応不要
情報提供
対応不要
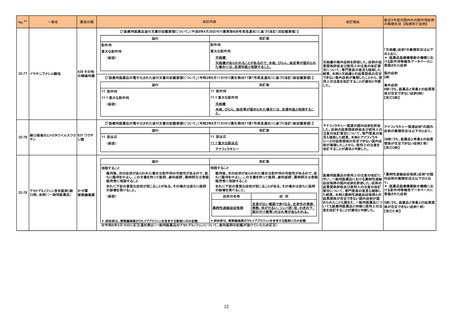
51
治験責任医師宛てに情報が発出された。HER2過剰発現の進行又は転移性非小細胞肺癌患者を対象に、本剤、デュルバルマブ(遺伝子組換え)及びプラチナ
トラスツズマブ デルクステカ 製剤を併用投与する臨床試験において、組入れ基準が以下のとおり変更になった。
イギリス
ン(遺伝子組換え)
・スクリーニング時にクレアチニンクリアランスが60mL/min以上(Cockcroft-Gault式による推定)であること
・本治験治療の開始までにプラチナ含有レジメンによる前治療から6カ月以上が経過していること
59 アザシチジン
米国において特定のロットが回収された。
アメリカ
回収
対応不要
62 メトホルミン塩酸塩
英国MHRAはメトホルミンによるビタミンB12欠乏症に関して、以下の内容を公表した。
・ビタミンB12欠乏症はメトホルミンを服用する10人に1人に影響を与える可能性がある一般的な副作用であること。
・ビタミンB12欠乏症の発現はメトホルミンの投与量、治療期間の長さに応じて増加すること。
・リスク因子保有患者(貧血、神経障害を合併する患者)に対して投与する際には定期的な血液検査の検討が必要であること。
イギリス
情報提供
対応済
65 オラパリブ
【第1報】
米国において医療従事者宛てに情報が発出された。主な内容は以下のとおり。
・無作為化第Ⅲ相試験のサブグループ解析の結果、化学療法による治療歴3回以上の生殖細胞系列BRCA変異を有する進行卵巣癌の患者について、標準治
療薬と比較して本剤投与時に全生存期間に悪影響が及ぼされる可能性が示唆された。
アメリカ
・製造販売業者は米国における「化学療法による治療歴3回以上の生殖細胞系列BRCA変異を有する進行卵巣癌」の適応を自主的に取り下げる。
【第2報】
米国において「化学療法による治療歴3回以上の生殖細胞系列BRCA変異を有する進行卵巣癌」の適応が取り下げられ、米国添付文書が改訂された。また、
適応の取り下げについて医療従事者宛てに情報が発出された。
情報提供
対応不要
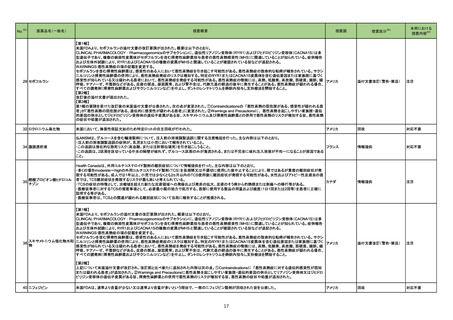
73 ベンラファキシン塩酸塩
米国添付文書が改訂され、主に以下のような記載の整備がなされた。
・Boxed Warningの項の自殺企図及び自殺念慮に関する注意喚起について、抗うつ剤を服用している患者すべてにおいて、臨床症状の悪化、自殺企図及び自
殺念慮の発現について注意深く観察する必要があることが記載された。
アメリカ
・Contraindicationの項のMAO阻害剤の注意喚起について、MAO阻害剤(リネゾリド、メチレンブルーを含む)を使用中または中止後14日以内は服用しないよう
にと記載された。
添付文書改訂(警告・禁忌)
注目
77 フルコナゾール
カナダ添付文書において、併用禁忌としてastemizoleが追加された。
カナダ
添付文書改訂(警告・禁忌)
対応不要
82 パクリタキセル
シンガポールにおいて、末梢動脈疾患に対するパクリタキセルコーティングデバイスの使用と死亡リスク増加又は四肢切断の関連を示唆する研究結果に基づ
き、情報が発出された。主な内容は以下のとおり。
・医療従事者は、パクリタキセルコーティングバルーンとステントの使用を検討する際、各患者の臨床的ベネフィット及びリスクを慎重に検討する必要がある。
・医療従事者は、パクリタキセルコーティングデバイスを使用する場合、可能な限りパクリタキセルの投与量を最小限に抑え、パクリタキセルコーティングデバイ
スの反復曝露を避けるなど、潜在的なパクリタキセルの用量依存的影響を軽減する必要がある。
・医療従事者は、現在の標準治療に従い、末梢動脈疾患に対してパクリタキセルコーティングデバイス治療を受けている患者の監視を継続する必要がある。
シンガポール
情報提供
対応不要
情報提供
対応不要
回収
対応不要
83
スイスにおいて情報が発出された。主な内容は以下のとおり。
イノツズマブ オゾガマイシン
・一部のロットのバイアルの底面に亀裂が観察された。医療従事者は投与前にバイアルを慎重に確認し、粉末等の外観が通常と異なる、バイアルに欠陥が見ら スイス
(遺伝子組換え)
れる場合等には、当該製品を使用してはならない。
85 アザシチジン
米国において、効能が通常より弱いことが確認されたため、特定のロットが回収された。
アメリカ
18
47
医薬品名(一般名)
措置概要
措置区分※3
措置国
治験責任医師宛てに情報が発出された。主な内容は以下のとおり。
ペムブロリズマブ(遺伝子組 ・新規ホルモン剤(アビラテロン酢酸エステル及びエンザルタミド等)による治療後に進行した転移性去勢抵抗性前立腺癌(mCRPC)の化学療法未治療患者を
換え)
対象とした二重盲検無作為化第Ⅲ相試験において、二つの主要評価項目の一つである全生存期間について、本剤、ドセタキセル及びプレドニゾロンの併用投
与の有効性が示されなかった。
アメリカ
本邦における
※4
措置内容
情報提供
対応不要
48 メキシレチン塩酸塩
英国MHRAはClinigen Healthcare Ltdがメキシレチン塩酸塩 50mg、100mg、および 200mg 硬カプセル剤の安定性試験において充填量の適正範囲から逸脱
の可能性が確認されたことを受けて、過少量投与又は過量投与の潜在的リスクがあるとして、これらの製剤の3 つのバッチについて回収を開始したことを公表し イギリス
た。
回収
対応不要
サルブタモール硫酸塩
フルチカゾンプロピオン酸エ
ステル
50
サルメテロールキシナホ酸
塩・フルチカゾンプロピオン酸
エステル
デンマークにおけるディスカス製剤のデバイス組み立てラインでのプラスチック片発生に伴う外部リコールの告知。
プラスチック片はデバイス内のパーツの破損に由来し、デバイス組み立て装置の設定不良により発生したものであると考えられた。デバイスの構造上、プラス
チック片がデバイスの吸入口に来ることはないため、患者へのリスクはなく、ディスカス自体の機能に与えるリスクも十分に低いことが確認された。
デンマーク
デンマーク医薬品庁はベントリンの1バッチの外部回収し、デンマーク市場向けFlixotideの第2バッチも内部回収の予定である。スイス、ニュージーランド、ポルト
ガルの各市場でも1バッチの内部回収が実施される予定である。
回収
対応不要
情報提供
対応不要
51
治験責任医師宛てに情報が発出された。HER2過剰発現の進行又は転移性非小細胞肺癌患者を対象に、本剤、デュルバルマブ(遺伝子組換え)及びプラチナ
トラスツズマブ デルクステカ 製剤を併用投与する臨床試験において、組入れ基準が以下のとおり変更になった。
イギリス
ン(遺伝子組換え)
・スクリーニング時にクレアチニンクリアランスが60mL/min以上(Cockcroft-Gault式による推定)であること
・本治験治療の開始までにプラチナ含有レジメンによる前治療から6カ月以上が経過していること
59 アザシチジン
米国において特定のロットが回収された。
アメリカ
回収
対応不要
62 メトホルミン塩酸塩
英国MHRAはメトホルミンによるビタミンB12欠乏症に関して、以下の内容を公表した。
・ビタミンB12欠乏症はメトホルミンを服用する10人に1人に影響を与える可能性がある一般的な副作用であること。
・ビタミンB12欠乏症の発現はメトホルミンの投与量、治療期間の長さに応じて増加すること。
・リスク因子保有患者(貧血、神経障害を合併する患者)に対して投与する際には定期的な血液検査の検討が必要であること。
イギリス
情報提供
対応済
65 オラパリブ
【第1報】
米国において医療従事者宛てに情報が発出された。主な内容は以下のとおり。
・無作為化第Ⅲ相試験のサブグループ解析の結果、化学療法による治療歴3回以上の生殖細胞系列BRCA変異を有する進行卵巣癌の患者について、標準治
療薬と比較して本剤投与時に全生存期間に悪影響が及ぼされる可能性が示唆された。
アメリカ
・製造販売業者は米国における「化学療法による治療歴3回以上の生殖細胞系列BRCA変異を有する進行卵巣癌」の適応を自主的に取り下げる。
【第2報】
米国において「化学療法による治療歴3回以上の生殖細胞系列BRCA変異を有する進行卵巣癌」の適応が取り下げられ、米国添付文書が改訂された。また、
適応の取り下げについて医療従事者宛てに情報が発出された。
情報提供
対応不要
73 ベンラファキシン塩酸塩
米国添付文書が改訂され、主に以下のような記載の整備がなされた。
・Boxed Warningの項の自殺企図及び自殺念慮に関する注意喚起について、抗うつ剤を服用している患者すべてにおいて、臨床症状の悪化、自殺企図及び自
殺念慮の発現について注意深く観察する必要があることが記載された。
アメリカ
・Contraindicationの項のMAO阻害剤の注意喚起について、MAO阻害剤(リネゾリド、メチレンブルーを含む)を使用中または中止後14日以内は服用しないよう
にと記載された。
添付文書改訂(警告・禁忌)
注目
77 フルコナゾール
カナダ添付文書において、併用禁忌としてastemizoleが追加された。
カナダ
添付文書改訂(警告・禁忌)
対応不要
82 パクリタキセル
シンガポールにおいて、末梢動脈疾患に対するパクリタキセルコーティングデバイスの使用と死亡リスク増加又は四肢切断の関連を示唆する研究結果に基づ
き、情報が発出された。主な内容は以下のとおり。
・医療従事者は、パクリタキセルコーティングバルーンとステントの使用を検討する際、各患者の臨床的ベネフィット及びリスクを慎重に検討する必要がある。
・医療従事者は、パクリタキセルコーティングデバイスを使用する場合、可能な限りパクリタキセルの投与量を最小限に抑え、パクリタキセルコーティングデバイ
スの反復曝露を避けるなど、潜在的なパクリタキセルの用量依存的影響を軽減する必要がある。
・医療従事者は、現在の標準治療に従い、末梢動脈疾患に対してパクリタキセルコーティングデバイス治療を受けている患者の監視を継続する必要がある。
シンガポール
情報提供
対応不要
情報提供
対応不要
回収
対応不要
83
スイスにおいて情報が発出された。主な内容は以下のとおり。
イノツズマブ オゾガマイシン
・一部のロットのバイアルの底面に亀裂が観察された。医療従事者は投与前にバイアルを慎重に確認し、粉末等の外観が通常と異なる、バイアルに欠陥が見ら スイス
(遺伝子組換え)
れる場合等には、当該製品を使用してはならない。
85 アザシチジン
米国において、効能が通常より弱いことが確認されたため、特定のロットが回収された。
アメリカ
18