よむ、つかう、まなぶ。
【資料5】医薬・生活衛生局からの定期報告 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
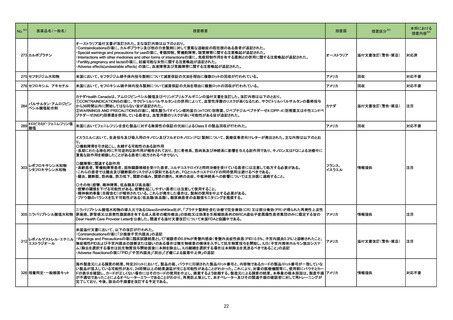
No.※2
医薬品名(一般名)
措置概要
措置区分※3
措置国
本邦における
※4
措置内容
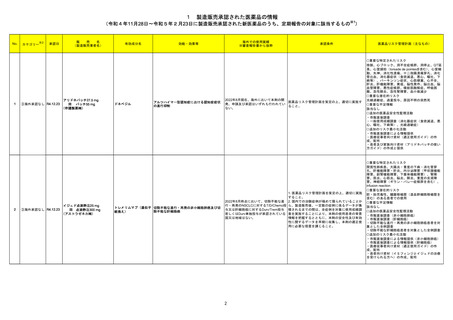
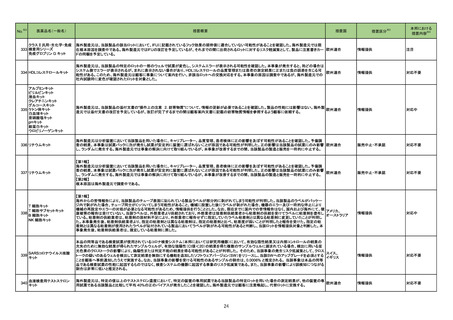
273 カルボプラチン
オーストラリア添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に、カルボプラチン及び他の白金製剤に対して重篤な過敏症の既往歴のある患者が追記された。
・Special warnings and precautions for useの項に、骨髄抑制、腎機能障害、聴覚障害に関する注意喚起が追記された。
・Interractions with other medicines and other forms of interactionsの項に、免疫抑制作用を有する薬剤との併用に関する注意喚起が追記された。
・Fertility,pregnancy and lactatの項に、妊娠可能な女性に関する注意喚起が追記された。
・Adverse effects(undesirable effects) の項に、血液障害及び胃腸障害に関する注意喚起が追記された。
オーストラリア
添付文書改訂(警告・禁忌)
対応済
275 セフタジジム水和物
米国において、セフタジジム硝子体内投与製剤について滅菌保証の欠如を理由に複数ロットの回収が行われている。
アメリカ
回収
対応不要
276 セフロキシム アキセチル
米国において、セフロキシム硝子体内投与製剤について滅菌保証の欠如を理由に複数ロットの回収が行われている。
アメリカ
回収
対応不要
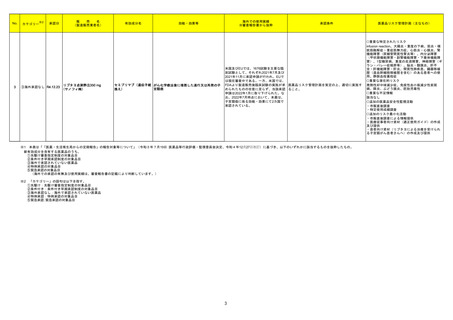
バルサルタン・アムロジピン
284
ベシル酸塩配合剤
カナダHealth Canadaは、アムロジピンベシル酸塩及びペリンドプリルアルギニンの添付文書を改訂した。改訂内容は以下のとおり。
①CONTRAINDICATIONSの項に、サクビトリル/バルサルタンとの併用によって、血管性浮腫のリスクが高くなるため、サクビトリル/バルサルタンの最終投与
から36時間以内に開始してはならない旨が追記された。
カナダ
②WARNINGS AND PRECAUTIONSの項に、哺乳類ラパマイシン標的蛋白(mTOR)阻害薬、ジペプチジルペプチダーゼ4(DPP‐4)阻害薬又は中性エンドペ
プチダーゼ(NEP)阻害薬を併用している患者は、血管浮腫のリスクが高い可能性がある旨が追記された。
添付文書改訂(警告・禁忌)
注目
アメリカ
回収
対応不要
フランス、
イスラエル
情報提供
注目
ニラパリブトシル酸塩水和物の導入元であるGlaxoSmithKline社が、「プラチナ製剤を含む治療で完全奏効(CR)又は部分奏効(PR)が得られた再発性上皮性
305 ニラパリブトシル酸塩水和物 卵巣癌、卵管癌又は原発性腹膜癌を有する成人患者の維持療法」の効能又は効果を生殖細胞系列のBRCA遺伝子変異陽性患者集団のみに限定する旨の
アメリカ
Dear Health Care Provider Letterを公表した。関連する添付文書改訂について米国FDAと協議中である。
情報提供
注目
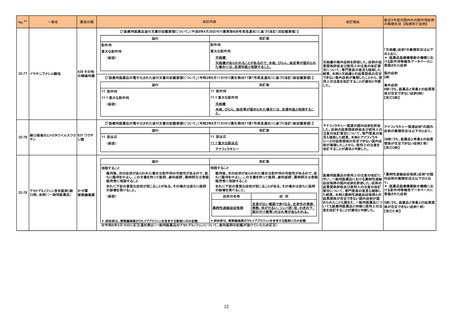
米国添付文書において、以下の改訂が行われた。
・Contraindicationsの項に「分娩後子宮内膜炎」の追記
レボノルゲストレル・エチニル ・Warnings and Precautionsの項に臨床試験結果として「被験者の0.8%が骨盤内感染(骨盤内炎症性疾患(PID)0.5%、子宮内膜炎0.3%)と診断されたこと、
312
アメリカ
エストラジオール
無症候性PIDおよび子宮内膜炎の診断または疑いのある場合は微生物検査の検体を入手して抗生物質投与を開始し、IUS(子宮内黄体ホルモン放出システ
ム)除去を選択する場合は抗生物質投与開始直後に本剤を除去し、IUS継続を選択する場合は本剤除去を見送るべきであること」の追記
・Adverse Reactionsの項に「PID」「子宮内膜炎」「脱出」「ざ瘡による装着中止例」の追記
添付文書改訂(警告・禁忌)
注目
情報提供
対応不要
289
トロピカミド・フェニレフリン塩
米国においてフェニレフリンを含む製品に対する無菌性の保証の欠如によるClassⅡの製品回収が行われた。
酸塩
イスラエルにおいて、全身投与及び吸入用のキノロン及びフルオロキノロン(FQ)製剤について、医療従事者向けレターが発出された。主な内容は以下のとお
り。
〇機能障害を引き起こし、永続する可能性のある副作用
・長期にわたる潜在的に不可逆的な副作用が報告されており、主に骨格系、筋肉系及び神経系に影響を与える副作用であり、キノロン又はFQによる治療中に
重篤な副作用を経験したことがある患者に処方されるべきでない。
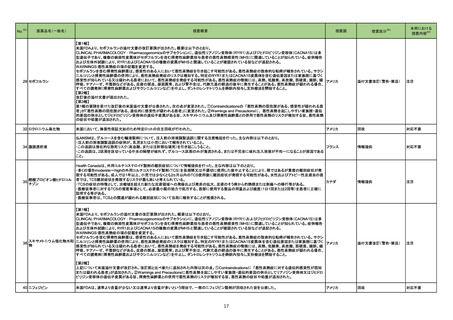
303
レボフロキサシン水和物
シタフロキサシン水和物
〇腱障害に関連する副作用
・高齢患者、腎機能障害患者、固形臓器移植を受けた患者、コルチコステロイドと同時治療を受けている患者には注意して処方する必要がある。
・これらの患者では腱炎及び腱断裂のリスクがより深刻であるため、FQとコルチコステロイドの同時使用は避けるべきである。
・腱炎、腱断裂、筋肉痛、筋力低下、関節の痛み、関節の腫れ、末梢の炎症、中枢神経系への影響については主治医に連絡すること。
〇その他(痙攣、精神障害、低血糖及び高血糖)
・痙攣の閾値を下げる可能性がある。痙攣を起こしやすい患者には注意して使用すること。
・精神病的事象(自殺含む)が報告されている。これらが発生した場合は、製剤の使用を中止する必要がある。
・ブドウ糖のバランスを乱す可能性がある(低血糖/高血糖)。糖尿病患者の血糖値モニタリングを推奨する。
326 培養同定・一般細菌キット
海外製造元による調査の結果、特定2ロットにおいて、製品の箱、パウチに印刷された製品/ロット番号と、内容物であるカードの製品/ロット番号が一致していな
い製品が混入している可能性があり、24時間以上の結果遅延が生じる可能性があることがわかった。これにより、対象の医療機関等に、使用前にパウチとカー
ドの表示を確認し、カードが正しくない場合にはそのカードの使用を中止し、廃棄するよう依頼する。製造元による調査の結果、本事象の根本原因は、製造手順 アメリカ
が不適切であったことによるオペレーターエラーであることがわかり、再発防止策として、本オペレーター及びその関連手順の確認者に対して再トレーニングが
完了しており、今後、該当の手順書を改訂する予定である。
22
医薬品名(一般名)
措置概要
措置区分※3
措置国
本邦における
※4
措置内容
273 カルボプラチン
オーストラリア添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に、カルボプラチン及び他の白金製剤に対して重篤な過敏症の既往歴のある患者が追記された。
・Special warnings and precautions for useの項に、骨髄抑制、腎機能障害、聴覚障害に関する注意喚起が追記された。
・Interractions with other medicines and other forms of interactionsの項に、免疫抑制作用を有する薬剤との併用に関する注意喚起が追記された。
・Fertility,pregnancy and lactatの項に、妊娠可能な女性に関する注意喚起が追記された。
・Adverse effects(undesirable effects) の項に、血液障害及び胃腸障害に関する注意喚起が追記された。
オーストラリア
添付文書改訂(警告・禁忌)
対応済
275 セフタジジム水和物
米国において、セフタジジム硝子体内投与製剤について滅菌保証の欠如を理由に複数ロットの回収が行われている。
アメリカ
回収
対応不要
276 セフロキシム アキセチル
米国において、セフロキシム硝子体内投与製剤について滅菌保証の欠如を理由に複数ロットの回収が行われている。
アメリカ
回収
対応不要
バルサルタン・アムロジピン
284
ベシル酸塩配合剤
カナダHealth Canadaは、アムロジピンベシル酸塩及びペリンドプリルアルギニンの添付文書を改訂した。改訂内容は以下のとおり。
①CONTRAINDICATIONSの項に、サクビトリル/バルサルタンとの併用によって、血管性浮腫のリスクが高くなるため、サクビトリル/バルサルタンの最終投与
から36時間以内に開始してはならない旨が追記された。
カナダ
②WARNINGS AND PRECAUTIONSの項に、哺乳類ラパマイシン標的蛋白(mTOR)阻害薬、ジペプチジルペプチダーゼ4(DPP‐4)阻害薬又は中性エンドペ
プチダーゼ(NEP)阻害薬を併用している患者は、血管浮腫のリスクが高い可能性がある旨が追記された。
添付文書改訂(警告・禁忌)
注目
アメリカ
回収
対応不要
フランス、
イスラエル
情報提供
注目
ニラパリブトシル酸塩水和物の導入元であるGlaxoSmithKline社が、「プラチナ製剤を含む治療で完全奏効(CR)又は部分奏効(PR)が得られた再発性上皮性
305 ニラパリブトシル酸塩水和物 卵巣癌、卵管癌又は原発性腹膜癌を有する成人患者の維持療法」の効能又は効果を生殖細胞系列のBRCA遺伝子変異陽性患者集団のみに限定する旨の
アメリカ
Dear Health Care Provider Letterを公表した。関連する添付文書改訂について米国FDAと協議中である。
情報提供
注目
米国添付文書において、以下の改訂が行われた。
・Contraindicationsの項に「分娩後子宮内膜炎」の追記
レボノルゲストレル・エチニル ・Warnings and Precautionsの項に臨床試験結果として「被験者の0.8%が骨盤内感染(骨盤内炎症性疾患(PID)0.5%、子宮内膜炎0.3%)と診断されたこと、
312
アメリカ
エストラジオール
無症候性PIDおよび子宮内膜炎の診断または疑いのある場合は微生物検査の検体を入手して抗生物質投与を開始し、IUS(子宮内黄体ホルモン放出システ
ム)除去を選択する場合は抗生物質投与開始直後に本剤を除去し、IUS継続を選択する場合は本剤除去を見送るべきであること」の追記
・Adverse Reactionsの項に「PID」「子宮内膜炎」「脱出」「ざ瘡による装着中止例」の追記
添付文書改訂(警告・禁忌)
注目
情報提供
対応不要
289
トロピカミド・フェニレフリン塩
米国においてフェニレフリンを含む製品に対する無菌性の保証の欠如によるClassⅡの製品回収が行われた。
酸塩
イスラエルにおいて、全身投与及び吸入用のキノロン及びフルオロキノロン(FQ)製剤について、医療従事者向けレターが発出された。主な内容は以下のとお
り。
〇機能障害を引き起こし、永続する可能性のある副作用
・長期にわたる潜在的に不可逆的な副作用が報告されており、主に骨格系、筋肉系及び神経系に影響を与える副作用であり、キノロン又はFQによる治療中に
重篤な副作用を経験したことがある患者に処方されるべきでない。
303
レボフロキサシン水和物
シタフロキサシン水和物
〇腱障害に関連する副作用
・高齢患者、腎機能障害患者、固形臓器移植を受けた患者、コルチコステロイドと同時治療を受けている患者には注意して処方する必要がある。
・これらの患者では腱炎及び腱断裂のリスクがより深刻であるため、FQとコルチコステロイドの同時使用は避けるべきである。
・腱炎、腱断裂、筋肉痛、筋力低下、関節の痛み、関節の腫れ、末梢の炎症、中枢神経系への影響については主治医に連絡すること。
〇その他(痙攣、精神障害、低血糖及び高血糖)
・痙攣の閾値を下げる可能性がある。痙攣を起こしやすい患者には注意して使用すること。
・精神病的事象(自殺含む)が報告されている。これらが発生した場合は、製剤の使用を中止する必要がある。
・ブドウ糖のバランスを乱す可能性がある(低血糖/高血糖)。糖尿病患者の血糖値モニタリングを推奨する。
326 培養同定・一般細菌キット
海外製造元による調査の結果、特定2ロットにおいて、製品の箱、パウチに印刷された製品/ロット番号と、内容物であるカードの製品/ロット番号が一致していな
い製品が混入している可能性があり、24時間以上の結果遅延が生じる可能性があることがわかった。これにより、対象の医療機関等に、使用前にパウチとカー
ドの表示を確認し、カードが正しくない場合にはそのカードの使用を中止し、廃棄するよう依頼する。製造元による調査の結果、本事象の根本原因は、製造手順 アメリカ
が不適切であったことによるオペレーターエラーであることがわかり、再発防止策として、本オペレーター及びその関連手順の確認者に対して再トレーニングが
完了しており、今後、該当の手順書を改訂する予定である。
22