よむ、つかう、まなぶ。
【資料5】医薬・生活衛生局からの定期報告 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
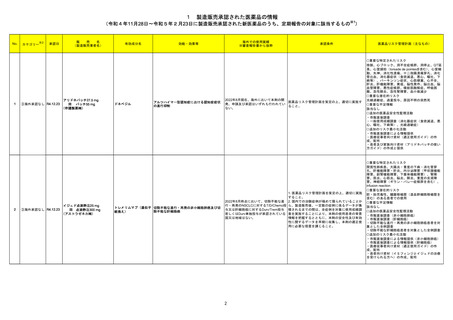
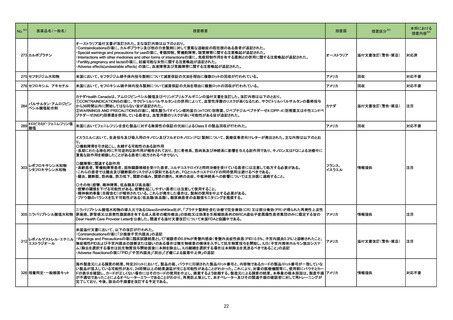
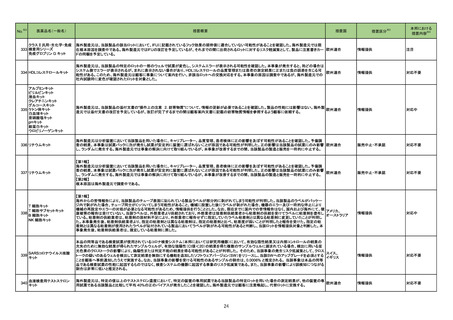
1 製造販売承認された医薬品の情報
(令和4年11月28日~令和5年2月23日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
2
カテゴリー
※2
承認日
③海外承認なし R4.12.23
③海外承認なし R4.12.23
販
売
名
(製造販売業者名)
アリドネパッチ27.5 mg
同 パッチ55 mg
(帝國製薬㈱)
イジュド点滴静注25 mg
同 点滴静注300 mg
(アストラゼネカ㈱)
有効成分名
ドネペジル
海外での使用実績
※審査報告書から抜粋
効能・効果等
アルツハイマー型認知症における認知症症状
の進行抑制
トレメリムマブ(遺伝子 切除不能な進行・再発の非小細胞肺癌及び切
除不能な肝細胞癌
組換え)
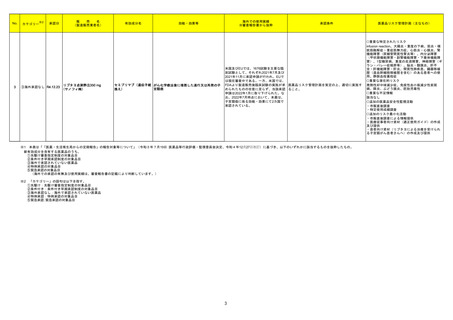
承認条件
医薬品リスク管理計画(主なもの)
2022年8月現在、海外において本剤の開
医薬品リスク管理計画を策定の上、適切に実施す
発、申請及び承認はいずれも行われてい
ること。
ない。
○重要な特定されたリスク
徐脈、心ブロック、洞不全症候群、洞停止、QT延
長、心室頻拍(torsade de pointesを含む)、心室細
動、失神、消化性潰瘍、十二指腸潰瘍穿孔、消化
管出血、消化器症状(食欲減退、悪心、嘔吐、下
痢等)、パーキンソン症状、心筋梗塞、心不全、
肝炎、肝機能障害、黄疸、脳性発作、脳出血、脳
血管障害、悪性症候群、横紋筋融解症、呼吸困
難、急性膵炎、急性腎障害、血小板減少
○重要な潜在的リスク
光線過敏症、過量投与、原因不明の突然死
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査(消化器症状(食欲減退、悪
心、嘔吐、下痢等)、光線過敏症)
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作
成、配布
・患者及び家族向け資材(アリドネパッチの使い
方ガイド)の作成と提供
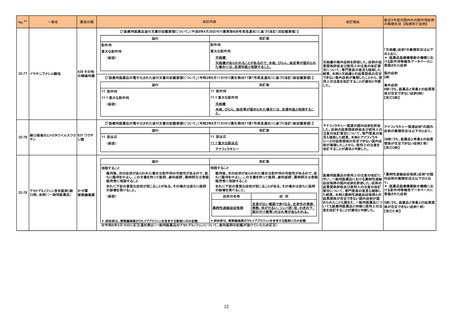
1. 医薬品リスク管理計画を策定の上、適切に実施
すること。
2022年8月時点において、切除不能な進 2. 国内での治験症例が極めて限られていることか
行・再発のNSCLCに対するT/D/Chemo投 ら、製造販売後、一定数の症例に係るデータが集
与又は肝細胞癌に対するDurv/Trem投与 積されるまでの間は、全症例を対象に使用成績調
若しくはDurv単独投与が承認されている 査を実施することにより、本剤の使用患者の背景
国又は地域はない。
情報を把握するとともに、本剤の安全性及び有効
性に関するデータを早期に収集し、本剤の適正使
用に必要な措置を講じること。
○重要な特定されたリスク
間質性肺疾患、大腸炎・重度の下痢・消化管穿
孔、肝機能障害・肝炎、内分泌障害(甲状腺機能
障害、副腎機能障害、下垂体機能障害)、腎障
害、筋炎、心筋炎、脳炎、膵炎、重度の皮膚障
害、神経障害(ギラン・バレー症候群を含む)、
infusion reaction
○重要な潜在的リスク
胚・胎児毒性、臓器移植歴(造血幹細胞移植歴を
含む)のある患者での使用
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査(非小細胞肺癌)
・市販直後調査(肝細胞癌)
・切除不能な進行・再発の非小細胞肺癌患者を対
象とした全例調査
・切除不能な肝細胞癌患者を対象とした全例調査
○追加のリスク最小化活動
・市販直後調査による情報提供(非小細胞肺癌)
・市販直後調査による情報提供(肝細胞癌)
・医療従事者向け資材(適正使用ガイド)の作
成、配布
・患者向け資材(イミフィンジとイジュドの治療
を受けられる方へ)の作成、配布
2
(令和4年11月28日~令和5年2月23日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
2
カテゴリー
※2
承認日
③海外承認なし R4.12.23
③海外承認なし R4.12.23
販
売
名
(製造販売業者名)
アリドネパッチ27.5 mg
同 パッチ55 mg
(帝國製薬㈱)
イジュド点滴静注25 mg
同 点滴静注300 mg
(アストラゼネカ㈱)
有効成分名
ドネペジル
海外での使用実績
※審査報告書から抜粋
効能・効果等
アルツハイマー型認知症における認知症症状
の進行抑制
トレメリムマブ(遺伝子 切除不能な進行・再発の非小細胞肺癌及び切
除不能な肝細胞癌
組換え)
承認条件
医薬品リスク管理計画(主なもの)
2022年8月現在、海外において本剤の開
医薬品リスク管理計画を策定の上、適切に実施す
発、申請及び承認はいずれも行われてい
ること。
ない。
○重要な特定されたリスク
徐脈、心ブロック、洞不全症候群、洞停止、QT延
長、心室頻拍(torsade de pointesを含む)、心室細
動、失神、消化性潰瘍、十二指腸潰瘍穿孔、消化
管出血、消化器症状(食欲減退、悪心、嘔吐、下
痢等)、パーキンソン症状、心筋梗塞、心不全、
肝炎、肝機能障害、黄疸、脳性発作、脳出血、脳
血管障害、悪性症候群、横紋筋融解症、呼吸困
難、急性膵炎、急性腎障害、血小板減少
○重要な潜在的リスク
光線過敏症、過量投与、原因不明の突然死
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査(消化器症状(食欲減退、悪
心、嘔吐、下痢等)、光線過敏症)
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作
成、配布
・患者及び家族向け資材(アリドネパッチの使い
方ガイド)の作成と提供
1. 医薬品リスク管理計画を策定の上、適切に実施
すること。
2022年8月時点において、切除不能な進 2. 国内での治験症例が極めて限られていることか
行・再発のNSCLCに対するT/D/Chemo投 ら、製造販売後、一定数の症例に係るデータが集
与又は肝細胞癌に対するDurv/Trem投与 積されるまでの間は、全症例を対象に使用成績調
若しくはDurv単独投与が承認されている 査を実施することにより、本剤の使用患者の背景
国又は地域はない。
情報を把握するとともに、本剤の安全性及び有効
性に関するデータを早期に収集し、本剤の適正使
用に必要な措置を講じること。
○重要な特定されたリスク
間質性肺疾患、大腸炎・重度の下痢・消化管穿
孔、肝機能障害・肝炎、内分泌障害(甲状腺機能
障害、副腎機能障害、下垂体機能障害)、腎障
害、筋炎、心筋炎、脳炎、膵炎、重度の皮膚障
害、神経障害(ギラン・バレー症候群を含む)、
infusion reaction
○重要な潜在的リスク
胚・胎児毒性、臓器移植歴(造血幹細胞移植歴を
含む)のある患者での使用
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査(非小細胞肺癌)
・市販直後調査(肝細胞癌)
・切除不能な進行・再発の非小細胞肺癌患者を対
象とした全例調査
・切除不能な肝細胞癌患者を対象とした全例調査
○追加のリスク最小化活動
・市販直後調査による情報提供(非小細胞肺癌)
・市販直後調査による情報提供(肝細胞癌)
・医療従事者向け資材(適正使用ガイド)の作
成、配布
・患者向け資材(イミフィンジとイジュドの治療
を受けられる方へ)の作成、配布
2