よむ、つかう、まなぶ。
【資料5】医薬・生活衛生局からの定期報告 (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
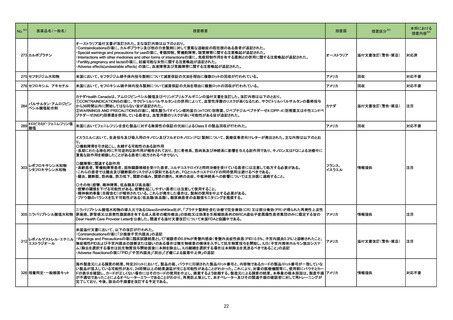
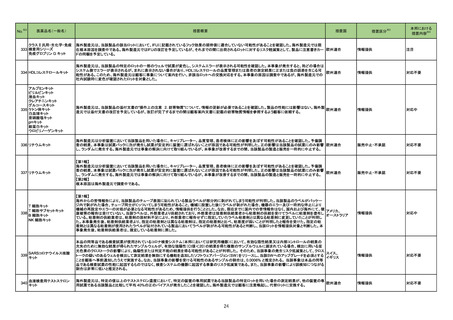
No.※2
医薬品名(一般名)
措置概要
措置区分※3
措置国
本邦における
※4
措置内容
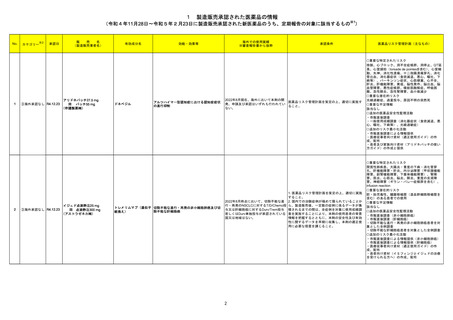
215 メトロニダゾール
欧州CMDhは、外用を除くメトロニダゾール含有製品に関して、PRACが勧告した以下の改訂に同意した。
<ヘリコバクター・ピロリの除菌の適応のみを有する製剤>
・Special warnings and precautions for useの項から、コケイン症候群の患者への投与に関する注意を削除し、Contraindicationsの項にコケイン症候群の患
者を追記。
<上記以外の製剤>
欧州連合
・Special warnings and precautions for useの項において、コケイン症候群の患者には十分なベネフィットリスク評価を行った上で投与すべきとの記載を、ベネ
フィットがリスクを上回ると考えられない限り投与すべきでない旨に変更。
<共通>
・Undesirable effectsの項に、コケイン症候群患者へのメトロニダゾールの全身使用において、急速に発症し致死的転帰を伴う症例を含む、重度の不可逆的肝
毒性、急性肝不全の症例が報告されている旨を追記。
添付文書改訂(警告・禁忌)
注目
218 乳酸リンゲル液
カナダにおける乳酸リンゲル注射液について、容器のラベル表示が「乳酸リンゲル注射液中20mmolのKCl」ではなく「0.9% NaCl中の40mmolのKCl」となって
いたことから、同一ロットの製品が回収された。
回収
対応不要
251 イオフルパン(123I)
【第1報】
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項における過敏症の既往歴のある患者について、重篤な過敏症の既往歴のある患者に更新された。
・Warnings and Precautionsの項において、
-過敏症の症状に呼吸困難、浮腫、発疹、紅斑、かゆみが追記された。
-I123 の甲状腺への取り込みは、甲状腺腫瘍の長期的なリスクを増加させる可能性がある旨が追記された。
-長期放射線被爆リスクの項を新設し、長期の放射線被爆は癌のリスクと関連していること、患者及び医療従事者は放射線曝露を最小限とするための安全な取
アメリカ
り扱いを確認すること、投与前後に水分補給をし、投与後に頻繁に排尿することを患者に助言することが追記された。
・Adverse Reactionsの項において、
-過敏症が追記された。
-市販後における有害事象として、過敏症の症状に呼吸困難、浮腫、紅斑が追記された。
・Drug Interactionsの項に、画像検査の結果に影響を及ぼす可能性のある薬剤としてarmodafinil、モダフィニルが追記された。
【第2報】
使用上の注意の記載状況、報告企業の意見、今後の対応が追記され、追加報されたもの。
添付文書改訂(警告・禁忌)
注目
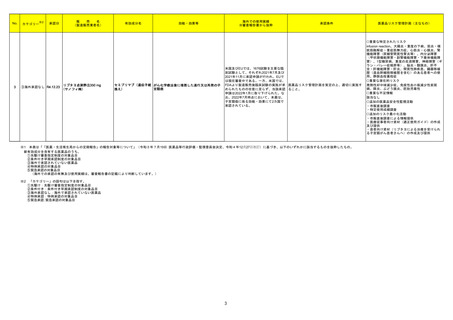
256 ドブタミン塩酸塩
豪州TGAはドブタミン塩酸塩の以下の項目について添付文書改訂を行ったことを報告した。
・ Contraindicationsの項に左室充満または流出に影響を及ぼす機械的閉塞の場合を追記
・ Special warnings and precautions for useの項に以下を追記
房室伝導の亢進、心室充満障害及び心室流出障害、過敏症、急性心筋梗塞に合併した心不全への使用、その他:肺内シャントの増加、急激な血圧低下
・ Interactions with other medicines and other forms of interactions 相互作用の併用注意としてに以下を追記
β-アドレナリン受容体拮抗薬、ニトログリセリン、エンタカポン
・Fertility, pregnancy and lactation受胎能、妊婦および授乳婦の項に以下を追記
母乳への移行は不明。本剤投与期間中は授乳の中断を考慮する。
・ Effects on ability to drive and use machines 機械の運転・使用能力の項への影響を新設。
機械の運転能力への影響は評価されていない。
・Adverse effects (undesirable effects) の項に以下を記載
心拍数増加,血圧上昇,心室性期外活動の増加、免疫系障害
添付文書改訂(警告・禁忌)
注目
262 ルキソリチニブリン酸塩
ヤヌスキナーゼ阻害剤(以下、「JAK阻害剤」)について、カナダで情報が発出された。主な内容は以下のとおり。
・JAK阻害剤の心血管系事象(Major Adverse Cardiovascular Events:MACE)、悪性腫瘍及び血栓症について、トファシチニブクエン酸塩の臨床試験成績及
びバリシチニブの観察研究結果を踏まえ、トファシチニブクエン酸塩と同様に、これらのリスクが否定できないとして、アブロシチニブ、fedratinib、ルキソリチニブ
カナダ
リン酸塩、バリシチニブ、ウパダシチニブ水和物の添付文書改訂を行う。
・医療従事者は、治療開始や治療継続前に添付文書を確認し、65歳以上の高齢者、現在または過去に喫煙歴がある者、他の心血管又は悪性腫瘍のリスクが
ある者、悪性腫瘍がある者、血栓増加のリスクがある者等については、ベネフィット及びリスクを個々に考慮すること。
情報提供
注目
回収
対応不要
265
カナダ
オーストラリア
精製ヒアルロン酸ナトリウム
精製ヒアルロン酸ナトリウム・ Fidia Farmaceutici S.p.A.社製のヒアルロン酸ナトリウム関節投与製品の特定バッチがドイツ国内で回収された。原因は、当該製品使用後24時間以内の関節
ドイツ
コンドロイチン硫酸エステル 痛の痛みと腫れ(既知、非重篤事象)の副作用情報件数が増加したためである。
ナトリウム
21
医薬品名(一般名)
措置概要
措置区分※3
措置国
本邦における
※4
措置内容
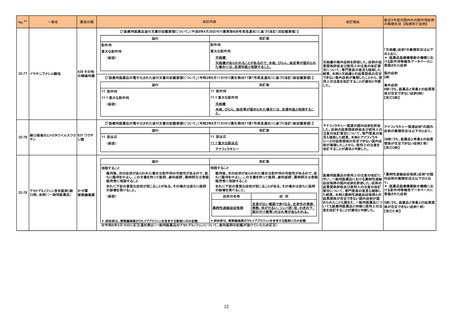
215 メトロニダゾール
欧州CMDhは、外用を除くメトロニダゾール含有製品に関して、PRACが勧告した以下の改訂に同意した。
<ヘリコバクター・ピロリの除菌の適応のみを有する製剤>
・Special warnings and precautions for useの項から、コケイン症候群の患者への投与に関する注意を削除し、Contraindicationsの項にコケイン症候群の患
者を追記。
<上記以外の製剤>
欧州連合
・Special warnings and precautions for useの項において、コケイン症候群の患者には十分なベネフィットリスク評価を行った上で投与すべきとの記載を、ベネ
フィットがリスクを上回ると考えられない限り投与すべきでない旨に変更。
<共通>
・Undesirable effectsの項に、コケイン症候群患者へのメトロニダゾールの全身使用において、急速に発症し致死的転帰を伴う症例を含む、重度の不可逆的肝
毒性、急性肝不全の症例が報告されている旨を追記。
添付文書改訂(警告・禁忌)
注目
218 乳酸リンゲル液
カナダにおける乳酸リンゲル注射液について、容器のラベル表示が「乳酸リンゲル注射液中20mmolのKCl」ではなく「0.9% NaCl中の40mmolのKCl」となって
いたことから、同一ロットの製品が回収された。
回収
対応不要
251 イオフルパン(123I)
【第1報】
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項における過敏症の既往歴のある患者について、重篤な過敏症の既往歴のある患者に更新された。
・Warnings and Precautionsの項において、
-過敏症の症状に呼吸困難、浮腫、発疹、紅斑、かゆみが追記された。
-I123 の甲状腺への取り込みは、甲状腺腫瘍の長期的なリスクを増加させる可能性がある旨が追記された。
-長期放射線被爆リスクの項を新設し、長期の放射線被爆は癌のリスクと関連していること、患者及び医療従事者は放射線曝露を最小限とするための安全な取
アメリカ
り扱いを確認すること、投与前後に水分補給をし、投与後に頻繁に排尿することを患者に助言することが追記された。
・Adverse Reactionsの項において、
-過敏症が追記された。
-市販後における有害事象として、過敏症の症状に呼吸困難、浮腫、紅斑が追記された。
・Drug Interactionsの項に、画像検査の結果に影響を及ぼす可能性のある薬剤としてarmodafinil、モダフィニルが追記された。
【第2報】
使用上の注意の記載状況、報告企業の意見、今後の対応が追記され、追加報されたもの。
添付文書改訂(警告・禁忌)
注目
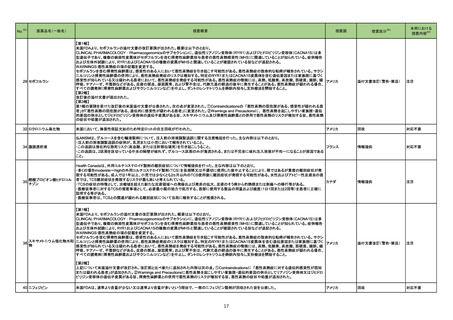
256 ドブタミン塩酸塩
豪州TGAはドブタミン塩酸塩の以下の項目について添付文書改訂を行ったことを報告した。
・ Contraindicationsの項に左室充満または流出に影響を及ぼす機械的閉塞の場合を追記
・ Special warnings and precautions for useの項に以下を追記
房室伝導の亢進、心室充満障害及び心室流出障害、過敏症、急性心筋梗塞に合併した心不全への使用、その他:肺内シャントの増加、急激な血圧低下
・ Interactions with other medicines and other forms of interactions 相互作用の併用注意としてに以下を追記
β-アドレナリン受容体拮抗薬、ニトログリセリン、エンタカポン
・Fertility, pregnancy and lactation受胎能、妊婦および授乳婦の項に以下を追記
母乳への移行は不明。本剤投与期間中は授乳の中断を考慮する。
・ Effects on ability to drive and use machines 機械の運転・使用能力の項への影響を新設。
機械の運転能力への影響は評価されていない。
・Adverse effects (undesirable effects) の項に以下を記載
心拍数増加,血圧上昇,心室性期外活動の増加、免疫系障害
添付文書改訂(警告・禁忌)
注目
262 ルキソリチニブリン酸塩
ヤヌスキナーゼ阻害剤(以下、「JAK阻害剤」)について、カナダで情報が発出された。主な内容は以下のとおり。
・JAK阻害剤の心血管系事象(Major Adverse Cardiovascular Events:MACE)、悪性腫瘍及び血栓症について、トファシチニブクエン酸塩の臨床試験成績及
びバリシチニブの観察研究結果を踏まえ、トファシチニブクエン酸塩と同様に、これらのリスクが否定できないとして、アブロシチニブ、fedratinib、ルキソリチニブ
カナダ
リン酸塩、バリシチニブ、ウパダシチニブ水和物の添付文書改訂を行う。
・医療従事者は、治療開始や治療継続前に添付文書を確認し、65歳以上の高齢者、現在または過去に喫煙歴がある者、他の心血管又は悪性腫瘍のリスクが
ある者、悪性腫瘍がある者、血栓増加のリスクがある者等については、ベネフィット及びリスクを個々に考慮すること。
情報提供
注目
回収
対応不要
265
カナダ
オーストラリア
精製ヒアルロン酸ナトリウム
精製ヒアルロン酸ナトリウム・ Fidia Farmaceutici S.p.A.社製のヒアルロン酸ナトリウム関節投与製品の特定バッチがドイツ国内で回収された。原因は、当該製品使用後24時間以内の関節
ドイツ
コンドロイチン硫酸エステル 痛の痛みと腫れ(既知、非重篤事象)の副作用情報件数が増加したためである。
ナトリウム
21