材ー1参考3○ 令和6年度保険医療材料制度の見直しについて (78 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212455_00041.html |
| 出典情報 | 中央社会保険医療協議会 保険医療材料専門部会(第127回 1/17)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
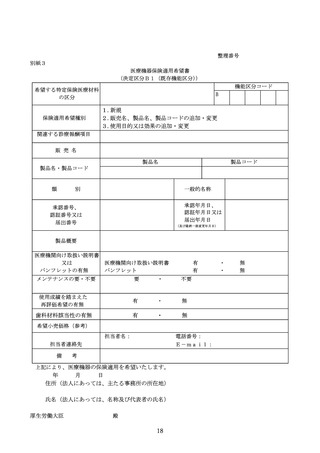
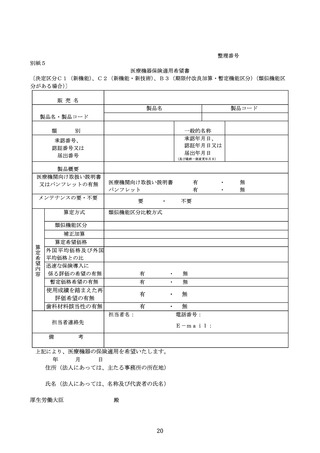
迅速な保険導入に係る評価に関する資料
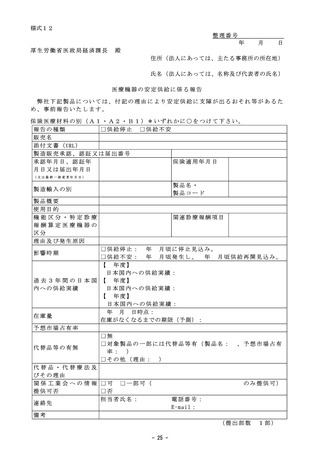
○日本及びアメリカ合衆国における承認申請状況
アメリカ合衆国における
食品医薬品化粧品法に基づく
承 認 申 請 状 況
承認
・
承認申請中
・
未申請
アメリカ合衆国における食品医薬品化粧品法に
基づく承認申請日(※1)
年
月
日
日本における医薬品医療機器法に基づく
承認申請日(※2)
年
月
日
上記の差((※2)-(※1))
日間
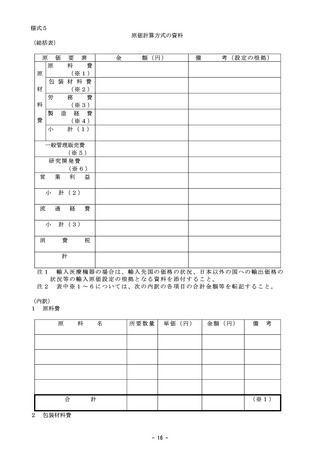
○医薬品医療機器法に基づく総審査期間のうち、申請者側の期間
□
新医療機器の優先品目又は改良医療機器の臨床あり
日間
□
新医療機器の通常品目
日間
□
その他
- 20 -