よむ、つかう、まなぶ。
資料No.2~2-1_日本薬局方の参考情報の改正(案)について (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
12 参考情報 .
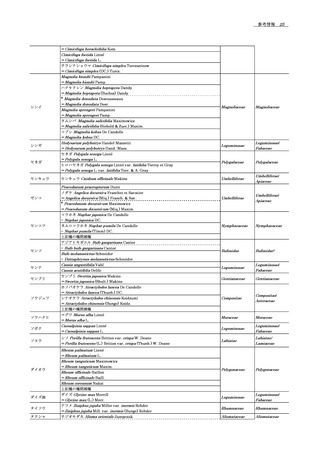
ゼ(Lys-Cエンドペプチ
ダーゼ) (EC 3.4.21.50)
ペプチドマップに影響を与えることを避けるため切断試薬の量
28
は最小限にする.酵素消化においては,タンパク質とプロテア
グルタミルエンドペプチ
グルタミン酸及びア
29
ーゼの質量比は20:1から200:1が一般的である.切断試薬が
ダーゼ(Glu-Cエンドプ
スパラギン酸残基のC
30
不安定な場合,複数回に分けて切断試薬を添加することにより
ロテアーゼV8プロテアー
末端側
31
切断効率が改善されるかもしれない.酵素は,固相支持体に結
ゼ) (S. aureus V8株由来)
32
合させることで,相対的に多量のプロテアーゼを用いることが
(EC 3.4.21.19)
33
でき,更に,酵素の自己消化物の混入及び酵素断片のペプチド
アスパラギン酸残基
34
マップへの影響を避けることができる.化学的な切断試薬は,
のN末端側
35
通常,大過剰で用いられ,消化終了時に除去する必要がある.
36
消化中の試料タンパク質の最適な濃度は,経験的に決定され
ペプチジル-Aspメタロ
エンドペプチダーゼ(Asp
-N エンドプロテアー
37
る.タンパク質及び部分消化されたタンパク質の凝集が起こら
アルギニン残基のC末
38
ないよう濃度は低くすべきであるが,続くクロマトグラフィー
端側
39
分離及び選択した検出法において,十分な検出感度で検出され
40
なければならない.試料の希釈又は遠心ろ過のような技術によ
メチオニン残基のC末
41
る試料の濃縮が必要な場合もある.試料タンパク質に行われる
端側
42
希釈又は濃縮ステップは,タンパク質医薬品の標準品/標準物
システイン残基のN
43
質にも同様に実施しなければならない.タンパク質の回収率は
ノ安息香酸
末端側
44
どんな濃縮ステップにおいても評価する必要があり,希釈又は
O -ヨードソ安息香酸
トリプトファン及び
45
濃縮の分析法の特異性及び精度に及ぼす影響は,開発段階で精
チロシン残基のC末端
46
査し,分析法バリデーションにおいて実施される頑健性の検討
側
47
に組み入れることを考慮すべきである.
アスパラギン酸及び
48
消化ステップにおいて,非特異的切断,脱アミド化,ジスル
プロリン残基
49
フィド結合の異性化,メチオニン残基の酸化,リシン残基のカ
50
ルバモイル化又はペプチドのN末端におけるグルタミンの脱ア
51
ミド化により生じたピログルタミル基の形成のような副反応の
52
結果,ペプチドマップが不明瞭になる可能性がある.自己消化
53
は,タンパク質消化酵素が酵素自体を消化することにより生じ
54
た無関係なピークをもたらす.自己消化により生じたペプチド
55
のピーク強度は,基質に対する酵素の比率及び使用した酵素の
56
修飾と品質によって異なる.自己消化を避けるため,タンパク
57
質消化酵素試液は,酵素活性を抑制するpHで調製するか,使
58
用直前に調製する.自己消化を防ぐようにプロテアーゼを改変
59
した修飾酵素が使用されることもある.酵素のリシン残基をメ
60
チル化又はアセチル化して自己消化部位の数を減少させた,市
61
販のトリプシン試薬(しばしばプロテオミクスグレードと呼ば
62
れる)も利用可能である.消化により生じたアーティファクト
63
を同定するために,試料タンパク質以外の全ての試薬を用いた
64
ブランクの消化試料を用いて空試験を行う.
65
5.
ゼ)(EC 3.4.24.33)
クロストリパイン(Arg-
C エンドペプチダーゼ)
(EC 3.4.22.8)
化学的
27
臭化シアン
手法
2-ニトロ-5-チオシア
希酸
3-ブロモ-3-メチル-
トリプトファン残基
2-(2-ニトロ フェニル
チオ -3H - イ ンド ール
(BNPS-スカトール)
1
タンパク質消化の効率及び再現性に影響を与える因子には,
2
pH,消化用緩衝液,温度,時間及びタンパク質に対する酵素
3
/試薬の比率などが含まれる.
4
最適な消化混合液のpHは,一般に酵素又は試薬により決定
5
される.選択されたpHでのアミノ酸の側鎖及びタンパク質の
6
修飾を含むペプチドの化学的安定性を考慮しなければならない.
7
例えば,臭化シアンを切断試薬として用いる場合は,強酸性条
8
件(例:pH 2,ギ酸)が必要である.一方,トリプシンを切断試
9
薬として用いる場合は,弱アルカリ性条件(pH 8)が適切である.
10
適切な温度は,切断試薬により異なる.例えば,ほとんどの
11
酵素は25 ~ 37℃の範囲内に最適な活性を持つ.温度は,酵素
12
の特異性をある程度決定することがある.このような場合,温
13
度を調整することによりある種のタンパク質に対する消化条件
14
を最適化することができる.理想的には,脱アミドのような試
15
料に関連する化学的副反応やタンパク質凝集を最小化し,一方
16
で,切断試薬の活性を維持しつつ試料タンパク質の消化に対す
17
る感受性を最大化するように消化温度を設定する.
18
消化の変動を避けるために,消化時間は意図した用途に十分
19
であることを確認することが必要である.不完全な消化による
20
ペプチド断片が最小限となるような十分な消化を確保するため
21
に,消化の経時変化に関する簡単な検討を実施すべきである.
22
消化時間を分から日の単位で変化させ,単一反応溶液から一定
23
量ずつとり適切に安定化し,分析を行うことで,タンパク質の
24
完全な消化に必要な時間を決定する.
25
実用的な時間内(例:2 ~ 20時間)で望ましいレベルの消化が
26
得られるように十分な切断試薬を用いるべきであるが,試薬が
分離
66
消化ステップにより得られたペプチド混合物のクロマトグラ
67
フィー分離は,その複雑さを解明し,データの適切な解釈が有
68
意義で再現性のあるものとなるようにしなければならない.ペ
69
プチドマップの複雑さにより,最終的に,最適なクロマトグラ
70
フィー条件,カラム及び移動相の組み合わせが求められる.分
71
析法の最適化実験は,最も質が高く再現性のあるクロマトグラ
72
ムを得るために必要となる.試料タンパク質の分子量もまた,
73
マップの複雑さと最適な分離に影響を及ぼす.
74
多くの技術(例:イオン交換高速液体クロマトグラフィー
75
[HPLC],疎水性相互作用HPLC,及びキャピラリー電気泳動)
76
はこれまでペプチドマップ分析におけるペプチド分離に用いら
77
れてきたが,本参考情報ではペプチドマップ法の分離ステップ
78
において最も一般的に用いられている方法である逆相HPLC
79
(RP-HPLC)に重点を置く.
80
クロマトグラフィーにおけるカラムは,それぞれのタンパク
ゼ(Lys-Cエンドペプチ
ダーゼ) (EC 3.4.21.50)
ペプチドマップに影響を与えることを避けるため切断試薬の量
28
は最小限にする.酵素消化においては,タンパク質とプロテア
グルタミルエンドペプチ
グルタミン酸及びア
29
ーゼの質量比は20:1から200:1が一般的である.切断試薬が
ダーゼ(Glu-Cエンドプ
スパラギン酸残基のC
30
不安定な場合,複数回に分けて切断試薬を添加することにより
ロテアーゼV8プロテアー
末端側
31
切断効率が改善されるかもしれない.酵素は,固相支持体に結
ゼ) (S. aureus V8株由来)
32
合させることで,相対的に多量のプロテアーゼを用いることが
(EC 3.4.21.19)
33
でき,更に,酵素の自己消化物の混入及び酵素断片のペプチド
アスパラギン酸残基
34
マップへの影響を避けることができる.化学的な切断試薬は,
のN末端側
35
通常,大過剰で用いられ,消化終了時に除去する必要がある.
36
消化中の試料タンパク質の最適な濃度は,経験的に決定され
ペプチジル-Aspメタロ
エンドペプチダーゼ(Asp
-N エンドプロテアー
37
る.タンパク質及び部分消化されたタンパク質の凝集が起こら
アルギニン残基のC末
38
ないよう濃度は低くすべきであるが,続くクロマトグラフィー
端側
39
分離及び選択した検出法において,十分な検出感度で検出され
40
なければならない.試料の希釈又は遠心ろ過のような技術によ
メチオニン残基のC末
41
る試料の濃縮が必要な場合もある.試料タンパク質に行われる
端側
42
希釈又は濃縮ステップは,タンパク質医薬品の標準品/標準物
システイン残基のN
43
質にも同様に実施しなければならない.タンパク質の回収率は
ノ安息香酸
末端側
44
どんな濃縮ステップにおいても評価する必要があり,希釈又は
O -ヨードソ安息香酸
トリプトファン及び
45
濃縮の分析法の特異性及び精度に及ぼす影響は,開発段階で精
チロシン残基のC末端
46
査し,分析法バリデーションにおいて実施される頑健性の検討
側
47
に組み入れることを考慮すべきである.
アスパラギン酸及び
48
消化ステップにおいて,非特異的切断,脱アミド化,ジスル
プロリン残基
49
フィド結合の異性化,メチオニン残基の酸化,リシン残基のカ
50
ルバモイル化又はペプチドのN末端におけるグルタミンの脱ア
51
ミド化により生じたピログルタミル基の形成のような副反応の
52
結果,ペプチドマップが不明瞭になる可能性がある.自己消化
53
は,タンパク質消化酵素が酵素自体を消化することにより生じ
54
た無関係なピークをもたらす.自己消化により生じたペプチド
55
のピーク強度は,基質に対する酵素の比率及び使用した酵素の
56
修飾と品質によって異なる.自己消化を避けるため,タンパク
57
質消化酵素試液は,酵素活性を抑制するpHで調製するか,使
58
用直前に調製する.自己消化を防ぐようにプロテアーゼを改変
59
した修飾酵素が使用されることもある.酵素のリシン残基をメ
60
チル化又はアセチル化して自己消化部位の数を減少させた,市
61
販のトリプシン試薬(しばしばプロテオミクスグレードと呼ば
62
れる)も利用可能である.消化により生じたアーティファクト
63
を同定するために,試料タンパク質以外の全ての試薬を用いた
64
ブランクの消化試料を用いて空試験を行う.
65
5.
ゼ)(EC 3.4.24.33)
クロストリパイン(Arg-
C エンドペプチダーゼ)
(EC 3.4.22.8)
化学的
27
臭化シアン
手法
2-ニトロ-5-チオシア
希酸
3-ブロモ-3-メチル-
トリプトファン残基
2-(2-ニトロ フェニル
チオ -3H - イ ンド ール
(BNPS-スカトール)
1
タンパク質消化の効率及び再現性に影響を与える因子には,
2
pH,消化用緩衝液,温度,時間及びタンパク質に対する酵素
3
/試薬の比率などが含まれる.
4
最適な消化混合液のpHは,一般に酵素又は試薬により決定
5
される.選択されたpHでのアミノ酸の側鎖及びタンパク質の
6
修飾を含むペプチドの化学的安定性を考慮しなければならない.
7
例えば,臭化シアンを切断試薬として用いる場合は,強酸性条
8
件(例:pH 2,ギ酸)が必要である.一方,トリプシンを切断試
9
薬として用いる場合は,弱アルカリ性条件(pH 8)が適切である.
10
適切な温度は,切断試薬により異なる.例えば,ほとんどの
11
酵素は25 ~ 37℃の範囲内に最適な活性を持つ.温度は,酵素
12
の特異性をある程度決定することがある.このような場合,温
13
度を調整することによりある種のタンパク質に対する消化条件
14
を最適化することができる.理想的には,脱アミドのような試
15
料に関連する化学的副反応やタンパク質凝集を最小化し,一方
16
で,切断試薬の活性を維持しつつ試料タンパク質の消化に対す
17
る感受性を最大化するように消化温度を設定する.
18
消化の変動を避けるために,消化時間は意図した用途に十分
19
であることを確認することが必要である.不完全な消化による
20
ペプチド断片が最小限となるような十分な消化を確保するため
21
に,消化の経時変化に関する簡単な検討を実施すべきである.
22
消化時間を分から日の単位で変化させ,単一反応溶液から一定
23
量ずつとり適切に安定化し,分析を行うことで,タンパク質の
24
完全な消化に必要な時間を決定する.
25
実用的な時間内(例:2 ~ 20時間)で望ましいレベルの消化が
26
得られるように十分な切断試薬を用いるべきであるが,試薬が
分離
66
消化ステップにより得られたペプチド混合物のクロマトグラ
67
フィー分離は,その複雑さを解明し,データの適切な解釈が有
68
意義で再現性のあるものとなるようにしなければならない.ペ
69
プチドマップの複雑さにより,最終的に,最適なクロマトグラ
70
フィー条件,カラム及び移動相の組み合わせが求められる.分
71
析法の最適化実験は,最も質が高く再現性のあるクロマトグラ
72
ムを得るために必要となる.試料タンパク質の分子量もまた,
73
マップの複雑さと最適な分離に影響を及ぼす.
74
多くの技術(例:イオン交換高速液体クロマトグラフィー
75
[HPLC],疎水性相互作用HPLC,及びキャピラリー電気泳動)
76
はこれまでペプチドマップ分析におけるペプチド分離に用いら
77
れてきたが,本参考情報ではペプチドマップ法の分離ステップ
78
において最も一般的に用いられている方法である逆相HPLC
79
(RP-HPLC)に重点を置く.
80
クロマトグラフィーにおけるカラムは,それぞれのタンパク