よむ、つかう、まなぶ。
資料No.2~2-1_日本薬局方の参考情報の改正(案)について (29 ページ)
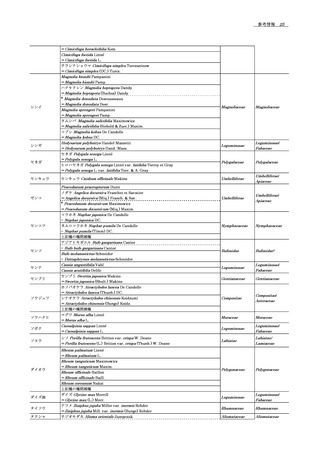
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考情報
1
3.
2
3.1.
測定時の留意事項
17 .
55
光強度の値はレーザーの出力等によって変動する相対的な値で
56
あり,コントロールサンプルの蛍光強度があらかじめ定めた一
3
信頼性と再現性の高いデータ取得のため,定期的に装置の校
57
定の範囲内になるように検出器の感度を設定することは,再現
4
正を実施する.多くのフローサイトメーターでは,装置の製造
58
性を担保する上で有用である.複数の蛍光色素を用いた多重染
5
業者から機器校正用のソフトウェアと試薬(通常は蛍光ビーズ)
59
色サンプルを分析する場合は,単一染色コントロールやFMO
6
が提供されており,これを用いて装置の校正を実施し,機器の
60
コントロールを用いてそれぞれの蛍光の他の検出器への漏れ込
7
性能のモニタリング状況(標準ビーズから得られる蛍光強度の
61
みを評価し,解析結果に影響しないように蛍光補正を設定する.
8
ばらつき,検出感度の設定など)を記録する.
62
陽性画分の割合(マーカー分子の発現割合等)を算出する場合に
9
3.2.
63
は,コントロールサンプルの蛍光強度を指標として,陽性・陰
装置の校正
コントロールサンプルの使用
10
バックグラウンドシグナルや非特異的なシグナルの特定と適
64
性画分を区別できるようにゲーティングを設定する.アッセイ
11
切な測定条件の設定のためにコントロールサンプルを使用する.
65
コントロール等を用いたシステム適合性を設定し,日常的な試
12
また,コントロールサンプルは日常的な試験の適格性評価(シ
66
験における測定条件が適切であることを確認する.
13
ステム適合性の判定など)にも用いられる.
67
3.4.
細胞と試薬の管理
14
未染色コントロール:解析対象とする細胞集団のゲーティン
68
使用する細胞や染色に用いる蛍光標識抗体などは試験の性能
15
グ,細胞の自家蛍光によるバックグラウンドを踏まえた検出器
69
や結果に影響を及ぼす重要試薬であるため,適格性を評価する
16
の調整と陰性領域の設定のため,未染色のサンプルを使用する.
70
ための項目と判定基準を定め,適切な方法で管理する.細胞は
17
アイソタイプコントロール:蛍光標識抗体を用いる場合,観
71
培養経過により形質の変化が生じる可能性があるため,セルバ
18
察された染色が目的抗原への特異的な結合によるものであるこ
72
ンクシステムを構築し,培養方法や継代回数の上限,試験時の
19
とを確認するため,使用する抗体と同一のイムノグロブリンサ
73
細胞の状態に関する規定(細胞生存率など)を定めて使用する.
20
ブクラスで,解析対象とする細胞には存在しない抗原に対する
74
特定の受容体等を標的とする試験に用いる場合には,標的受容
21
抗体で染色したコントロールを用いる.アイソタイプコントロ
75
体の発現量を規格として定めて管理する.試験実施時には,ア
22
ールに用いる抗体は試験に用いる抗体と同じ蛍光色素が同程度
76
ッセイコントロールを用いて,使用した細胞が期待される細胞
23
の割合で標識されていることが求められる.アイソタイプコン
77
応答を示すことを試験ごとに確認することも重要である.染色
24
トロールは抗体や蛍光色素の細胞への非特異的結合や,単球や
78
に用いる蛍光標識抗体や細胞の刺激に用いるサイトカイン等は
25
マクロファージ等の免疫細胞上に存在するFc受容体への抗体
79
用途への適合性を確認した上で使用する.タンパク質試薬は市
26
結合のようなバックグラウンドの評価に用いられる.
80
販品であってもロットごとに比活性が異なることがあるため,
27
単一染色コントロール:複数種類の蛍光色素を用いた試験を
81
ロット更新時には新旧ロットの比較を行い,必要に応じて添加
28
実施する際には,異なる蛍光色素間の漏れ込みを評価して蛍光
82
濃度を調整して試験に使用する.
29
補正を行うため,試験に用いる各蛍光色素について,単独で染
83
4.
30
色したコントロールを使用する.
84
4.1.
生物薬品の試験における使用例
目的物質の標的細胞への結合活性の評価
31
FMO (Fluorescence Minus One)コントロール:FMOコン
85
目的物質が細胞表面に存在する標的タンパク質と結合して薬
32
トロールは,染色に用いる全ての蛍光色素から一つの蛍光色素
86
理作用を発揮する場合(細胞膜タンパク質を標的とする抗体,
33
だけを除いたコントロールである.欠けている蛍光色素のチャ
87
ホルモン・サイトカイン類など),フローサイトメトリーによ
34
ンネルへの他の蛍光色素の漏れ込みから,蛍光補正が正しく行
88
り標的分子を発現する細胞に対する目的物質の結合活性を評価
35
われていることを確認する.陰性/陽性画分を判定するゲーテ
89
することができる.細胞を用いた結合試験は,より生理的な条
36
ィングの設定にも使用できる.
90
件下で細胞膜上に存在する標的タンパク質に対する結合活性を
37
生物学的コントロール(アッセイコントロール):上記の染色
91
評価できるという利点を有しており,組換えタンパク質の精製
38
に関するコントロールとは別に,実施する試験に対応する陽性
92
が困難な複数回膜貫通タンパク質に対する結合試験にも有用で
39
コントロール及び陰性コントロールとなる試料を調製する.例
93
ある.一方で,試験に用いた細胞に存在する本来の標的以外の
40
えば,細胞応答に伴うマーカー分子の発現量の変化を測定する
94
分子への非特異的結合が生じる可能性もあり,検出される結合
41
試験では,未処理/未刺激のサンプルや確実に細胞応答が生じ
95
の特異性について留意する必要がある.
42
ることが既知の処理を施したサンプルをコントロールとして使
96
測定方法としては,他の原理の結合試験と同様に非競合法あ
43
用する.これらのアッセイコントロールの測定データはシステ
97
るいは競合法が使用される.非競合法では,目的物質に対する
44
ム適合性の判定に用いることができる.
98
蛍光標識抗体(例えば,抗体医薬品に対する蛍光標識抗ヒト
45
3.3.
99
IgG抗体)を用いて,標的細胞への目的物質の結合を検出する.
測定条件の設定
46
試料測定の際には,検出しようとする蛍光に適した光学系を
100
競合法では,蛍光標識した標準物質等と試料を混合して標的細
47
選択し,コントロールサンプルを用いて検出器の感度,ゲーテ
101
胞に添加し,蛍光標識体の標的細胞への結合に対する試料の阻
48
ィング,蛍光補正を設定する.通常,最初にFSC/SSCプロッ
102
害活性を測定する.適切な希釈倍数で調製した試料の希釈系列
49
トにおいて解析対象とする細胞集団が適切に表示されるように
103
について試験を行って得られたシグナル(平均蛍光強度)から用
50
FSCとSSCの検出感度を調整し,解析対象の細胞集団をゲー
104
量反応曲線を作成し,最大反応の50%に相当するシグナルを
51
ティングする.次に検出しようとする蛍光パラメーターについ
105
与える用量(非競合法ではEC50,競合法ではIC50)を算出する.
52
てヒストグラムやドットプロットを展開し,未染色コントロー
106
標準物質に対する相対活性を求める場合には,標準物質と試料
53
ルや陽性・陰性コントロールにおいて検出される蛍光が測定範
107
についてそれぞれ用量反応曲線を作成し,EC50あるいはIC50の
54
囲内に含まれるように検出器の感度を調整する.検出される蛍
108
比を算出する.
1
3.
2
3.1.
測定時の留意事項
17 .
55
光強度の値はレーザーの出力等によって変動する相対的な値で
56
あり,コントロールサンプルの蛍光強度があらかじめ定めた一
3
信頼性と再現性の高いデータ取得のため,定期的に装置の校
57
定の範囲内になるように検出器の感度を設定することは,再現
4
正を実施する.多くのフローサイトメーターでは,装置の製造
58
性を担保する上で有用である.複数の蛍光色素を用いた多重染
5
業者から機器校正用のソフトウェアと試薬(通常は蛍光ビーズ)
59
色サンプルを分析する場合は,単一染色コントロールやFMO
6
が提供されており,これを用いて装置の校正を実施し,機器の
60
コントロールを用いてそれぞれの蛍光の他の検出器への漏れ込
7
性能のモニタリング状況(標準ビーズから得られる蛍光強度の
61
みを評価し,解析結果に影響しないように蛍光補正を設定する.
8
ばらつき,検出感度の設定など)を記録する.
62
陽性画分の割合(マーカー分子の発現割合等)を算出する場合に
9
3.2.
63
は,コントロールサンプルの蛍光強度を指標として,陽性・陰
装置の校正
コントロールサンプルの使用
10
バックグラウンドシグナルや非特異的なシグナルの特定と適
64
性画分を区別できるようにゲーティングを設定する.アッセイ
11
切な測定条件の設定のためにコントロールサンプルを使用する.
65
コントロール等を用いたシステム適合性を設定し,日常的な試
12
また,コントロールサンプルは日常的な試験の適格性評価(シ
66
験における測定条件が適切であることを確認する.
13
ステム適合性の判定など)にも用いられる.
67
3.4.
細胞と試薬の管理
14
未染色コントロール:解析対象とする細胞集団のゲーティン
68
使用する細胞や染色に用いる蛍光標識抗体などは試験の性能
15
グ,細胞の自家蛍光によるバックグラウンドを踏まえた検出器
69
や結果に影響を及ぼす重要試薬であるため,適格性を評価する
16
の調整と陰性領域の設定のため,未染色のサンプルを使用する.
70
ための項目と判定基準を定め,適切な方法で管理する.細胞は
17
アイソタイプコントロール:蛍光標識抗体を用いる場合,観
71
培養経過により形質の変化が生じる可能性があるため,セルバ
18
察された染色が目的抗原への特異的な結合によるものであるこ
72
ンクシステムを構築し,培養方法や継代回数の上限,試験時の
19
とを確認するため,使用する抗体と同一のイムノグロブリンサ
73
細胞の状態に関する規定(細胞生存率など)を定めて使用する.
20
ブクラスで,解析対象とする細胞には存在しない抗原に対する
74
特定の受容体等を標的とする試験に用いる場合には,標的受容
21
抗体で染色したコントロールを用いる.アイソタイプコントロ
75
体の発現量を規格として定めて管理する.試験実施時には,ア
22
ールに用いる抗体は試験に用いる抗体と同じ蛍光色素が同程度
76
ッセイコントロールを用いて,使用した細胞が期待される細胞
23
の割合で標識されていることが求められる.アイソタイプコン
77
応答を示すことを試験ごとに確認することも重要である.染色
24
トロールは抗体や蛍光色素の細胞への非特異的結合や,単球や
78
に用いる蛍光標識抗体や細胞の刺激に用いるサイトカイン等は
25
マクロファージ等の免疫細胞上に存在するFc受容体への抗体
79
用途への適合性を確認した上で使用する.タンパク質試薬は市
26
結合のようなバックグラウンドの評価に用いられる.
80
販品であってもロットごとに比活性が異なることがあるため,
27
単一染色コントロール:複数種類の蛍光色素を用いた試験を
81
ロット更新時には新旧ロットの比較を行い,必要に応じて添加
28
実施する際には,異なる蛍光色素間の漏れ込みを評価して蛍光
82
濃度を調整して試験に使用する.
29
補正を行うため,試験に用いる各蛍光色素について,単独で染
83
4.
30
色したコントロールを使用する.
84
4.1.
生物薬品の試験における使用例
目的物質の標的細胞への結合活性の評価
31
FMO (Fluorescence Minus One)コントロール:FMOコン
85
目的物質が細胞表面に存在する標的タンパク質と結合して薬
32
トロールは,染色に用いる全ての蛍光色素から一つの蛍光色素
86
理作用を発揮する場合(細胞膜タンパク質を標的とする抗体,
33
だけを除いたコントロールである.欠けている蛍光色素のチャ
87
ホルモン・サイトカイン類など),フローサイトメトリーによ
34
ンネルへの他の蛍光色素の漏れ込みから,蛍光補正が正しく行
88
り標的分子を発現する細胞に対する目的物質の結合活性を評価
35
われていることを確認する.陰性/陽性画分を判定するゲーテ
89
することができる.細胞を用いた結合試験は,より生理的な条
36
ィングの設定にも使用できる.
90
件下で細胞膜上に存在する標的タンパク質に対する結合活性を
37
生物学的コントロール(アッセイコントロール):上記の染色
91
評価できるという利点を有しており,組換えタンパク質の精製
38
に関するコントロールとは別に,実施する試験に対応する陽性
92
が困難な複数回膜貫通タンパク質に対する結合試験にも有用で
39
コントロール及び陰性コントロールとなる試料を調製する.例
93
ある.一方で,試験に用いた細胞に存在する本来の標的以外の
40
えば,細胞応答に伴うマーカー分子の発現量の変化を測定する
94
分子への非特異的結合が生じる可能性もあり,検出される結合
41
試験では,未処理/未刺激のサンプルや確実に細胞応答が生じ
95
の特異性について留意する必要がある.
42
ることが既知の処理を施したサンプルをコントロールとして使
96
測定方法としては,他の原理の結合試験と同様に非競合法あ
43
用する.これらのアッセイコントロールの測定データはシステ
97
るいは競合法が使用される.非競合法では,目的物質に対する
44
ム適合性の判定に用いることができる.
98
蛍光標識抗体(例えば,抗体医薬品に対する蛍光標識抗ヒト
45
3.3.
99
IgG抗体)を用いて,標的細胞への目的物質の結合を検出する.
測定条件の設定
46
試料測定の際には,検出しようとする蛍光に適した光学系を
100
競合法では,蛍光標識した標準物質等と試料を混合して標的細
47
選択し,コントロールサンプルを用いて検出器の感度,ゲーテ
101
胞に添加し,蛍光標識体の標的細胞への結合に対する試料の阻
48
ィング,蛍光補正を設定する.通常,最初にFSC/SSCプロッ
102
害活性を測定する.適切な希釈倍数で調製した試料の希釈系列
49
トにおいて解析対象とする細胞集団が適切に表示されるように
103
について試験を行って得られたシグナル(平均蛍光強度)から用
50
FSCとSSCの検出感度を調整し,解析対象の細胞集団をゲー
104
量反応曲線を作成し,最大反応の50%に相当するシグナルを
51
ティングする.次に検出しようとする蛍光パラメーターについ
105
与える用量(非競合法ではEC50,競合法ではIC50)を算出する.
52
てヒストグラムやドットプロットを展開し,未染色コントロー
106
標準物質に対する相対活性を求める場合には,標準物質と試料
53
ルや陽性・陰性コントロールにおいて検出される蛍光が測定範
107
についてそれぞれ用量反応曲線を作成し,EC50あるいはIC50の
54
囲内に含まれるように検出器の感度を調整する.検出される蛍
108
比を算出する.