よむ、つかう、まなぶ。
資料No.2~2-1_日本薬局方の参考情報の改正(案)について (28 ページ)
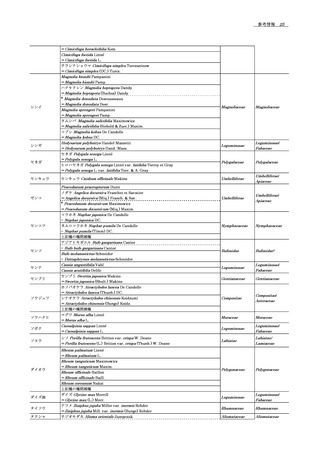
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
16 参考情報 .
46
1
2
図1
フローサイトメーターの構成
ピュータ上での処理が可能なデジタル値に変換される.
47
細胞の染色に2種類以上の蛍光色素を同時に使用する場合,
48
各色素の蛍光スペクトルの一部が重なることがあり,この場合,
49
各蛍光検出器は意図した蛍光色素に由来する特異的な蛍光に加
50
えて他の色素が発した蛍光を検出する.このような蛍光の漏れ
51
込みの問題を解決するため,蛍光補正(コンペンセーション)を
52
実施する.試験に使用するそれぞれの蛍光色素について単独で
53
染色した試料などを用いることで,各蛍光色素の他の検出器へ
54
の漏れ込みを計算し,干渉するシグナルを選択的に差し引いた
55
データを取得することができる.上記のプロセスを経て個々の
多くのフローサイトメーターでは,細胞懸濁液は流路系によ
56
細胞について得られた増幅・補正済みの各パラメーター(FSC,
4
ってフローセルまで運ばれ,シース液による流体力学的絞り込
57
SSC,蛍光)に関するデータが解析に使用される.
5
み(ハイドロダイナミックフォーカシング)によって細胞が一列
58
2.
6
に並んだ細い流束が形成され,細胞が1個ずつ観察ポイント(レ
59
2.1.
7
ーザー照射点)を通過する.光源としては,アルゴンレーザー
60
フローサイトメトリーで得られたデータは様々な方法で表
8
(488 nm),ヘリウム-ネオンレーザー(633 nm)のほか,種々
61
示・解析することができる(図2).一般的な表示方法の一つが
9
の波長のダイオードレーザー等が複数組み合わせて搭載される
62
ヒストグラムであり,X軸に一つの測定パラメーターのシグナ
10
ことが一般的であり,検出しようとする蛍光に適した光源が選
63
ル強度を,Y軸に細胞数を表示する.ヒストグラムは特定のマ
11
択される.細胞がレーザー照射点を通過すると細胞の物理的構
64
ーカー分子の発現量や発現割合の評価に有用である.また,X
12
造によって様々な方向への散乱光が生じるほか,蛍光色素が励
65
軸とY軸にそれぞれ異なるパラメーターのシグナル強度をプロ
起されることで固有の蛍光が放出される.
66
ットしたドットプロットは2種類の細胞表面マーカーを組み合
67
わせた細胞集団の特定や,その割合の評価等に用いられる.
3
13
14
レーザーの光軸の前方(通常は20°以内の角度)への散乱は前
15
方散乱光(FSC:Forward Scatter)と呼ばれ,細胞が大きいほ
16
ど強くなるため,FSCを測定することにより細胞の相対的な
17
大きさを推定することができる.レーザーの光軸に対して90°
18
方向への散乱を側方散乱光(SSC:Side Scatter)と呼ぶ.SSC
19
の強度は細胞内の顆粒の量や種類,核や細胞膜の形態等の影響
20
を受けるため,細胞構造の複雑性の指標となる(細胞の内部構
21
造の複雑性が高いほどSSC強度は高くなる).
22
蛍光シグナルは光源の種類に依存して,細胞内に含まれる蛍
23
光物質や特定の解析を目的として使用した蛍光プローブ(蛍光
24
色素,蛍光標識タンパク質,蛍光タンパク質等)から生じる.
25
細胞から放出された蛍光は,光学系によって分離されて個別の
26
チャネルで検出される.光学フィルターには,特定の波長以上
27
を通過させるロングパスフィルター,特定の波長以下を通過さ
28
せるショートパスフィルター,特定の狭い波長範囲のみを通過
29
させるバンドパスフィルターがあり,入射光に対して一定の角
30
度で設置したダイクロイックミラーと組み合わせることで,特
31
定の波長をもつ蛍光が目的のチャネルに振り分けられる.検出
32
の特異性は光学系の設定に依存するため,検出しようとする蛍
33
光に適した組み合わせとする必要がある.
34
光学フィルターによって振り分けられた散乱光及び蛍光は光
35
電子増倍管(PMT:Photomultiplier Tube)やフォトダイオード
36
によって検出され,電圧パルスに変換される.PMTで検出さ
37
れる電圧パルスは検出器に電圧を加えることで増幅することが
38
できる.増幅の方法には線形(Linear)と対数(Log)の2種類があ
39
り,一般に細胞の散乱光(FSC,SSC)には線形増幅が,蛍光の
40
測定には対数増幅が使用されることが多い.試料に含まれる微
41
粒子(細胞片等の夾雑物)に由来するシグナルなどの実験データ
42
とは無関係なデータの取得を防ぐため,通常はFSCに閾値を
43
設定する.閾値を超えないシグナルは全ての検出器で無視され
44
る.電圧パルスはアナログ値であり,現在使用されるフローサ
45
イトメーターの多くでは,アナログ-デジタル変換によりコン
データ解析
データの表示
68
69
70
図2
2.2.
データ表示の例
ゲーティング
71
取得したデータの中には解析に不要な死細胞や細胞片などの
72
夾雑物,解析対象ではない細胞集団由来のシグナルが含まれる
73
ことがあり,目的とする細胞集団に限定した解析を行うために
74
ゲーティングを行う.通常,最初にFSCとSSCによる細胞の
75
形態学的特性に基づいたゲーティングを実施する.例えば,生
76
細胞よりもFSCが小さくSSCが大きい死細胞や細胞片は,
77
FSC/SSCプロットにおけるゲーティングにより解析対象から
78
除外することができる.また,血液サンプルの解析では,細胞
79
の大きさと複雑性の違いに基づき,FSC/SSCプロットを用い
80
てリンパ球と顆粒球を区別してゲーティングすることができる.
81
細胞表面マーカーに対する蛍光標識抗体を用いた測定では,特
82
定のマーカー分子(例えば,T細胞におけるCD3,B細胞におけ
83
るCD19など)を発現する細胞集団をゲーティングして解析する
84
ことができる.解析ソフトウェアを用いて,段階的な複数のゲ
85
ーティングを設定することが可能である.ゲーティングにより
86
絞り込まれた解析対象とする細胞集団について,試験に用いた
87
蛍光標識物質が結合する細胞の割合(例えば,蛍光標識抗体が
88
認識するマーカー分子が発現する細胞の割合),結合量の指標
89
となる平均蛍光強度などを算出する.
46
1
2
図1
フローサイトメーターの構成
ピュータ上での処理が可能なデジタル値に変換される.
47
細胞の染色に2種類以上の蛍光色素を同時に使用する場合,
48
各色素の蛍光スペクトルの一部が重なることがあり,この場合,
49
各蛍光検出器は意図した蛍光色素に由来する特異的な蛍光に加
50
えて他の色素が発した蛍光を検出する.このような蛍光の漏れ
51
込みの問題を解決するため,蛍光補正(コンペンセーション)を
52
実施する.試験に使用するそれぞれの蛍光色素について単独で
53
染色した試料などを用いることで,各蛍光色素の他の検出器へ
54
の漏れ込みを計算し,干渉するシグナルを選択的に差し引いた
55
データを取得することができる.上記のプロセスを経て個々の
多くのフローサイトメーターでは,細胞懸濁液は流路系によ
56
細胞について得られた増幅・補正済みの各パラメーター(FSC,
4
ってフローセルまで運ばれ,シース液による流体力学的絞り込
57
SSC,蛍光)に関するデータが解析に使用される.
5
み(ハイドロダイナミックフォーカシング)によって細胞が一列
58
2.
6
に並んだ細い流束が形成され,細胞が1個ずつ観察ポイント(レ
59
2.1.
7
ーザー照射点)を通過する.光源としては,アルゴンレーザー
60
フローサイトメトリーで得られたデータは様々な方法で表
8
(488 nm),ヘリウム-ネオンレーザー(633 nm)のほか,種々
61
示・解析することができる(図2).一般的な表示方法の一つが
9
の波長のダイオードレーザー等が複数組み合わせて搭載される
62
ヒストグラムであり,X軸に一つの測定パラメーターのシグナ
10
ことが一般的であり,検出しようとする蛍光に適した光源が選
63
ル強度を,Y軸に細胞数を表示する.ヒストグラムは特定のマ
11
択される.細胞がレーザー照射点を通過すると細胞の物理的構
64
ーカー分子の発現量や発現割合の評価に有用である.また,X
12
造によって様々な方向への散乱光が生じるほか,蛍光色素が励
65
軸とY軸にそれぞれ異なるパラメーターのシグナル強度をプロ
起されることで固有の蛍光が放出される.
66
ットしたドットプロットは2種類の細胞表面マーカーを組み合
67
わせた細胞集団の特定や,その割合の評価等に用いられる.
3
13
14
レーザーの光軸の前方(通常は20°以内の角度)への散乱は前
15
方散乱光(FSC:Forward Scatter)と呼ばれ,細胞が大きいほ
16
ど強くなるため,FSCを測定することにより細胞の相対的な
17
大きさを推定することができる.レーザーの光軸に対して90°
18
方向への散乱を側方散乱光(SSC:Side Scatter)と呼ぶ.SSC
19
の強度は細胞内の顆粒の量や種類,核や細胞膜の形態等の影響
20
を受けるため,細胞構造の複雑性の指標となる(細胞の内部構
21
造の複雑性が高いほどSSC強度は高くなる).
22
蛍光シグナルは光源の種類に依存して,細胞内に含まれる蛍
23
光物質や特定の解析を目的として使用した蛍光プローブ(蛍光
24
色素,蛍光標識タンパク質,蛍光タンパク質等)から生じる.
25
細胞から放出された蛍光は,光学系によって分離されて個別の
26
チャネルで検出される.光学フィルターには,特定の波長以上
27
を通過させるロングパスフィルター,特定の波長以下を通過さ
28
せるショートパスフィルター,特定の狭い波長範囲のみを通過
29
させるバンドパスフィルターがあり,入射光に対して一定の角
30
度で設置したダイクロイックミラーと組み合わせることで,特
31
定の波長をもつ蛍光が目的のチャネルに振り分けられる.検出
32
の特異性は光学系の設定に依存するため,検出しようとする蛍
33
光に適した組み合わせとする必要がある.
34
光学フィルターによって振り分けられた散乱光及び蛍光は光
35
電子増倍管(PMT:Photomultiplier Tube)やフォトダイオード
36
によって検出され,電圧パルスに変換される.PMTで検出さ
37
れる電圧パルスは検出器に電圧を加えることで増幅することが
38
できる.増幅の方法には線形(Linear)と対数(Log)の2種類があ
39
り,一般に細胞の散乱光(FSC,SSC)には線形増幅が,蛍光の
40
測定には対数増幅が使用されることが多い.試料に含まれる微
41
粒子(細胞片等の夾雑物)に由来するシグナルなどの実験データ
42
とは無関係なデータの取得を防ぐため,通常はFSCに閾値を
43
設定する.閾値を超えないシグナルは全ての検出器で無視され
44
る.電圧パルスはアナログ値であり,現在使用されるフローサ
45
イトメーターの多くでは,アナログ-デジタル変換によりコン
データ解析
データの表示
68
69
70
図2
2.2.
データ表示の例
ゲーティング
71
取得したデータの中には解析に不要な死細胞や細胞片などの
72
夾雑物,解析対象ではない細胞集団由来のシグナルが含まれる
73
ことがあり,目的とする細胞集団に限定した解析を行うために
74
ゲーティングを行う.通常,最初にFSCとSSCによる細胞の
75
形態学的特性に基づいたゲーティングを実施する.例えば,生
76
細胞よりもFSCが小さくSSCが大きい死細胞や細胞片は,
77
FSC/SSCプロットにおけるゲーティングにより解析対象から
78
除外することができる.また,血液サンプルの解析では,細胞
79
の大きさと複雑性の違いに基づき,FSC/SSCプロットを用い
80
てリンパ球と顆粒球を区別してゲーティングすることができる.
81
細胞表面マーカーに対する蛍光標識抗体を用いた測定では,特
82
定のマーカー分子(例えば,T細胞におけるCD3,B細胞におけ
83
るCD19など)を発現する細胞集団をゲーティングして解析する
84
ことができる.解析ソフトウェアを用いて,段階的な複数のゲ
85
ーティングを設定することが可能である.ゲーティングにより
86
絞り込まれた解析対象とする細胞集団について,試験に用いた
87
蛍光標識物質が結合する細胞の割合(例えば,蛍光標識抗体が
88
認識するマーカー分子が発現する細胞の割合),結合量の指標
89
となる平均蛍光強度などを算出する.