よむ、つかう、まなぶ。
【参考資料4】参考資料4_感染症法等ガイドライン(案) (69 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37715.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第10回 2/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
Ⅱ
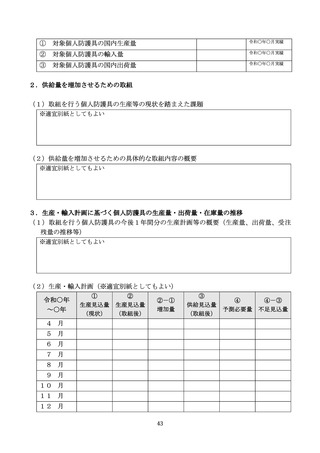
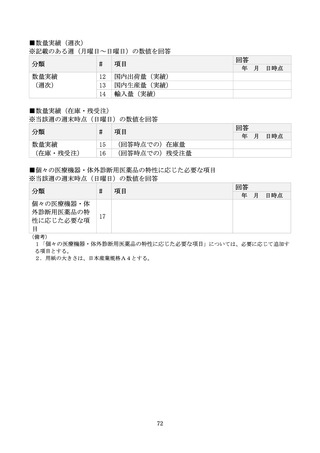
生産量等
17
18
19
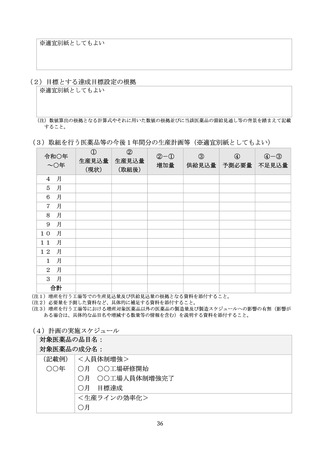
平時の生産量及び最大生産量
本年度の月平均の生産実績及び最大生産量を記載する。
平時の出荷量
本年度の月平均の出荷実績を記載する。
平時の在庫量
本年度の月平均の在庫(最終製品)実績を記載する。
20
生産量(足下)
21
出荷量(足下)
22
在庫量(足下)
23
同成分での代替薬
24
他成分での代替薬
25
診療ガイドライン等での位置付け
注1
26
27
供給不足の理由
28
上記の理由
29
Ⅲ
本年度の月平均実績を 100 とした場合の直近の月平均の
生産実績の比を記載する。
本年度の月平均実績を 100 とした場合の直近の月平均の
出荷実績の比を記載する。
本年度の月平均実績を 100 とした場合の直近の月平均の
在庫(最終製品)実績の比を記載する。
関係学会及び該当医薬品の製販企業と調整を行い、代替
可能な期間や量についても記載する。
関係学会及び該当医薬品の製販企業と調整を行い、代替
可能な期間や量についても記載する。
診療ガイドライン等での記載状況を記載する。該当箇所
を参考資料として添付する。
供給不足(供給停止、限定出荷)になっている理由につ
いて記載する。
改善見込み時期
その他(
改善見込み時期を記載する。
その理由については、各社が改善に向けて取り組んでい
る内容もあわせて記載すること。
)
その他事項
30
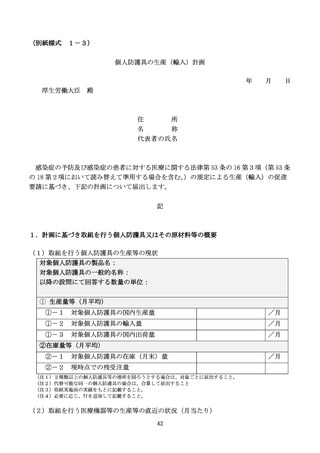
原薬調達状況
原薬調達状況に変化があれば記載する。併せてサプライ
チェーンを簡単に補足する。
31
製造委託先の状況
製造委託先の状況に変化があれば記載する。
生産計画
別表
33
同成分医薬品での影響度
これまでの使用実績などから考えられる臨床への影響度
を記載する。
34
35
学会等への相談状況
関係学会か助言等を記載する。
注2
32
36
37
その他(
)
諸外国での承認状況のほか、同規格の品目の存在有無を
記載する。
諸外国での供給状況等のほか、輸入が可能であると考え
られる場合にその時期や数量等の見通しを記載する。
国からの要請や指示である場合は、根拠条項やその内容
を記載する。
輸送・保管手段について特記すべきものがあれば記載す
る。
諸外国における同一成分規格の有無
上記の供給見通し
38
国からの出荷要請等の有無
39
輸送・保管手段
40
その他(
(原薬等について出荷要請等)
)
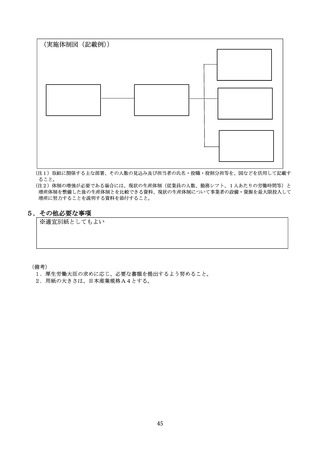
(注1)需要の増加、製造等トラブル、原材料等調達トラブルなど、製造の支障となっている事項を全て記載する。需要
の増加については、増産出来ない理由を、製造キャパシティ、採算性、医療上の優先度低下、その他の中から選択
するとともに、その他については、具体的に記載する。
(注2)報告時点から前後1年間分の生産量、供給量、在庫量の計画(今後の見込み)及び実績を記載する。単位(錠な
ど)を設定すること。
69
生産量等
17
18
19
平時の生産量及び最大生産量
本年度の月平均の生産実績及び最大生産量を記載する。
平時の出荷量
本年度の月平均の出荷実績を記載する。
平時の在庫量
本年度の月平均の在庫(最終製品)実績を記載する。
20
生産量(足下)
21
出荷量(足下)
22
在庫量(足下)
23
同成分での代替薬
24
他成分での代替薬
25
診療ガイドライン等での位置付け
注1
26
27
供給不足の理由
28
上記の理由
29
Ⅲ
本年度の月平均実績を 100 とした場合の直近の月平均の
生産実績の比を記載する。
本年度の月平均実績を 100 とした場合の直近の月平均の
出荷実績の比を記載する。
本年度の月平均実績を 100 とした場合の直近の月平均の
在庫(最終製品)実績の比を記載する。
関係学会及び該当医薬品の製販企業と調整を行い、代替
可能な期間や量についても記載する。
関係学会及び該当医薬品の製販企業と調整を行い、代替
可能な期間や量についても記載する。
診療ガイドライン等での記載状況を記載する。該当箇所
を参考資料として添付する。
供給不足(供給停止、限定出荷)になっている理由につ
いて記載する。
改善見込み時期
その他(
改善見込み時期を記載する。
その理由については、各社が改善に向けて取り組んでい
る内容もあわせて記載すること。
)
その他事項
30
原薬調達状況
原薬調達状況に変化があれば記載する。併せてサプライ
チェーンを簡単に補足する。
31
製造委託先の状況
製造委託先の状況に変化があれば記載する。
生産計画
別表
33
同成分医薬品での影響度
これまでの使用実績などから考えられる臨床への影響度
を記載する。
34
35
学会等への相談状況
関係学会か助言等を記載する。
注2
32
36
37
その他(
)
諸外国での承認状況のほか、同規格の品目の存在有無を
記載する。
諸外国での供給状況等のほか、輸入が可能であると考え
られる場合にその時期や数量等の見通しを記載する。
国からの要請や指示である場合は、根拠条項やその内容
を記載する。
輸送・保管手段について特記すべきものがあれば記載す
る。
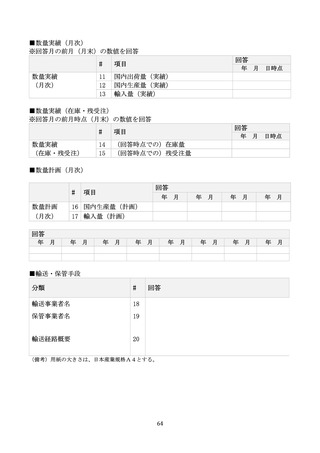
諸外国における同一成分規格の有無
上記の供給見通し
38
国からの出荷要請等の有無
39
輸送・保管手段
40
その他(
(原薬等について出荷要請等)
)
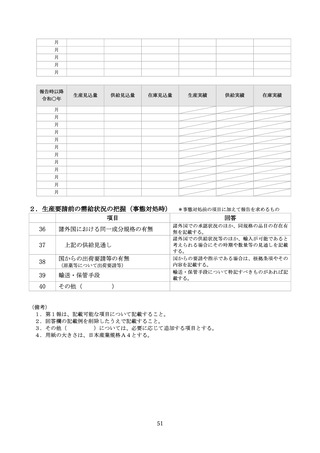
(注1)需要の増加、製造等トラブル、原材料等調達トラブルなど、製造の支障となっている事項を全て記載する。需要
の増加については、増産出来ない理由を、製造キャパシティ、採算性、医療上の優先度低下、その他の中から選択
するとともに、その他については、具体的に記載する。
(注2)報告時点から前後1年間分の生産量、供給量、在庫量の計画(今後の見込み)及び実績を記載する。単位(錠な
ど)を設定すること。
69