よむ、つかう、まなぶ。
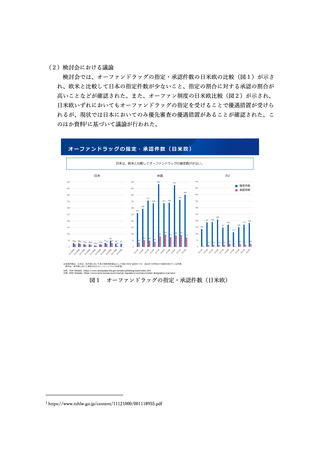
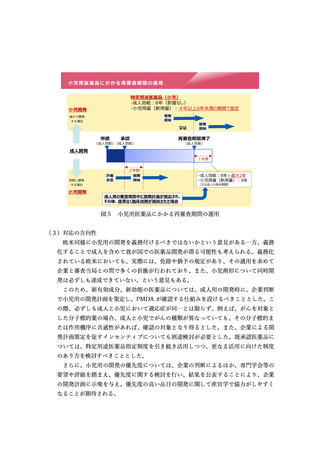
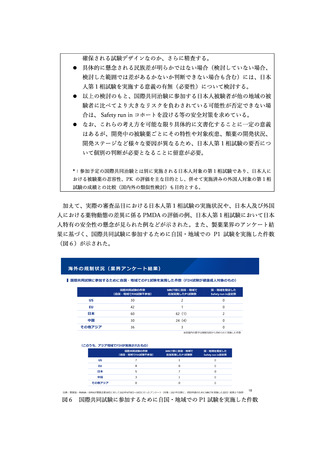
【資料5】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書(案) (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38892.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第9回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
の迅速な実用化を両立するため、国際共同治験実施前の日本人第1相試験の必要性に
係る考え方を整理することとした。
(2)検討会における議論
検討会での議論は、2回に分けて行われた。
1回目の議論は、事務局作成の資料5 に基づいて行われた。また、日本製薬工業協
会・柏谷構成員から資料6が提出された。
製薬業界の意見としては、次のような内容が示された。
国際共同治験の参加前に日本人第1相試験を実施すると、国際共同治験への日本
の参加の遅れ、日本の不参加、さらには日本での開発断念に繋がる場合がある状
況を踏まえ、日本人第1相試験の実施に関して、製薬業界からは次のような意見
を受けている。
⚫ 国際共同治験に参加する前に、日本人第1相試験の実施が原則として必要
であるとの現在の考え方を変更し、利用可能なデータから安全性・忍容性
のリスクが説明でき許容・管理可能な場合には、日本人第1相試験を実施
せずとも、国際共同治験に参加できる考え方を原則としてはどうか。
⚫ 日本人第1相試験の要否について PMDA と企業の判断の基準にはギャップ
がある。安全性・忍容性のリスク評価についての観点や考え方を可能な限
り具体的に文書化することで、PMDA や治験実施施設、企業(ベンチャー
を含む)を含めた関係者の共通理解を高めたい。
また、現時点の PMDA の考え方としては、次のような内容が示された。
国際共同治験に日本が遅滞なく参加し、迅速な薬事承認に結びつける観点から、
日本人第1相試験*の実施に関して、下記のとおり柔軟に対応している。
⚫ 国際共同治験に参加する前に一律に日本人第1相試験の実施を求めてはお
らず、その時点で利用可能な情報を基に、疾患と被験薬の特徴も踏まえ
て、その実施の要否を品目ごとに検討している(実際には、さらに患者数
や国際共同治験のスケジュールも考慮)
。
⚫ 具体的に懸念される民族差がないことが明らかな場合には、日本人第1相
試験を実施せずとも、国際共同治験に参加することに問題はない。
⚫ 先行する海外試験の情報、類薬の情報、疾患の特性等から具体的に懸念さ
れる民族差とその差の程度が推定できる場合には、日本人第1相試験の実
施が不要と判断できる可能性があるため、差の程度に応じて国際共同治験
に参加することの是非を検討し、「是」の場合は、日本人被験者の安全が
5
https://www.mhlw.go.jp/content/11121000/001131631.pdf
6
https://www.mhlw.go.jp/content/11121000/001131632.pdf
係る考え方を整理することとした。
(2)検討会における議論
検討会での議論は、2回に分けて行われた。
1回目の議論は、事務局作成の資料5 に基づいて行われた。また、日本製薬工業協
会・柏谷構成員から資料6が提出された。
製薬業界の意見としては、次のような内容が示された。
国際共同治験の参加前に日本人第1相試験を実施すると、国際共同治験への日本
の参加の遅れ、日本の不参加、さらには日本での開発断念に繋がる場合がある状
況を踏まえ、日本人第1相試験の実施に関して、製薬業界からは次のような意見
を受けている。
⚫ 国際共同治験に参加する前に、日本人第1相試験の実施が原則として必要
であるとの現在の考え方を変更し、利用可能なデータから安全性・忍容性
のリスクが説明でき許容・管理可能な場合には、日本人第1相試験を実施
せずとも、国際共同治験に参加できる考え方を原則としてはどうか。
⚫ 日本人第1相試験の要否について PMDA と企業の判断の基準にはギャップ
がある。安全性・忍容性のリスク評価についての観点や考え方を可能な限
り具体的に文書化することで、PMDA や治験実施施設、企業(ベンチャー
を含む)を含めた関係者の共通理解を高めたい。
また、現時点の PMDA の考え方としては、次のような内容が示された。
国際共同治験に日本が遅滞なく参加し、迅速な薬事承認に結びつける観点から、
日本人第1相試験*の実施に関して、下記のとおり柔軟に対応している。
⚫ 国際共同治験に参加する前に一律に日本人第1相試験の実施を求めてはお
らず、その時点で利用可能な情報を基に、疾患と被験薬の特徴も踏まえ
て、その実施の要否を品目ごとに検討している(実際には、さらに患者数
や国際共同治験のスケジュールも考慮)
。
⚫ 具体的に懸念される民族差がないことが明らかな場合には、日本人第1相
試験を実施せずとも、国際共同治験に参加することに問題はない。
⚫ 先行する海外試験の情報、類薬の情報、疾患の特性等から具体的に懸念さ
れる民族差とその差の程度が推定できる場合には、日本人第1相試験の実
施が不要と判断できる可能性があるため、差の程度に応じて国際共同治験
に参加することの是非を検討し、「是」の場合は、日本人被験者の安全が
5
https://www.mhlw.go.jp/content/11121000/001131631.pdf
6
https://www.mhlw.go.jp/content/11121000/001131632.pdf