よむ、つかう、まなぶ。
【資料5】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書(案) (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38892.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第9回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
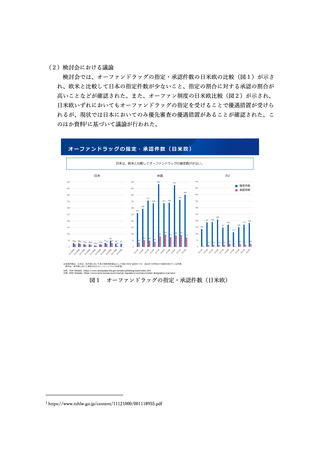
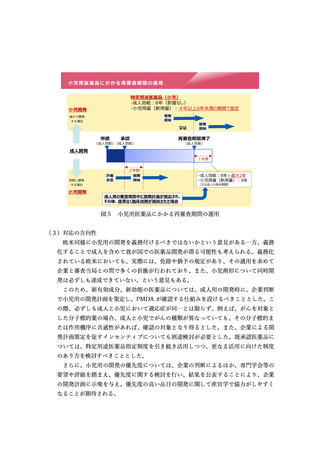
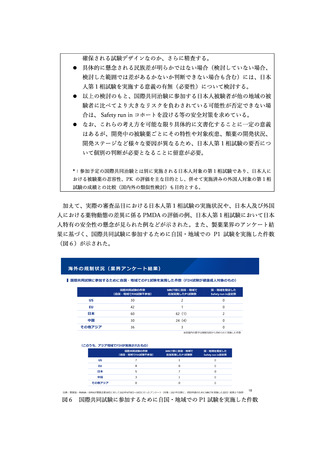
の国際共同治験に係る考え方等が示された。
構成員からは、次のような意見が出た。
▍日本人データの必要性について
⚫ 小児癌などの超希少疾患であっても全て日本人治験を行う必要がないとは
思わない。これから行われる国際共同治験であれば参加すべき。
⚫ 医療現場としては日本人症例は必要という感覚。超希少疾患で、海外で検
証的試験が実施済みであれば、日本人の治験がなくとも仕方ない感覚はあ
るが、治験の空洞化という意味での心配もある。
⚫ 少数例であっても国際共同治験に参加した経験を通じて、医療機関での経
験・ノウハウの蓄積に繋がった。一方で、経験・ノウハウの蓄積は別の方
法で培うべきであり、必ずしも規制によって促すべきではない。
⚫ 薬剤の特性、構造から民族差が想定されるかといった要素も考慮要素とし
て重要。日本人での用量を検討することは必要。PK データが必要になるこ
とはあるのではないか。
⚫ 統計的な解釈ができなくとも、日本人のデータがあることで医療現場・患
者の安心感に繋がる。基本的には必要なものであるという考え方は維持す
べき。
⚫ これまでは日本人のデータを求めてきたが、多くの医薬品部会上程品の場
合、外国人と同様の傾向である印象。
⚫ 既に海外で臨床試験が行われ、ラグになってしまっている医薬品について
は、さらに国内治験を行うことでラグが長期化してしまうことを避けるた
め、国内データは承認と並行して収集してもいいのではないか。
▍議論の対象について
⚫ 専門医のみが使用するような医薬品と、クリニックで幅広く使われる医薬
品では、考え方を分ける必要がある。
⚫ まずは超希少疾患という切り口で始めてもよいと思うが、将来的な方向性
も併せて議論すべき。ドラッグラグの解決が目的であれば、患者数ではな
く、臨床試験のフィージビリティの観点で定義するべき。
⚫ 抗がん剤の領域では、患者数が 1000 人いれば臨床試験が一定程度は実施可
能。500 人を下回るあたりから、試験の実施が困難になってくる印象。
⚫ 比較的ゆっくり状態を保てる疾患と、急激に状態が悪くなる疾患では取扱
いが異なるのでは。
⚫ 超希少疾患の定義をすることは難しいと思うが、総合判断をする場合であ
っても、どのような切り口で判断をするのか、考え方を示すことが重要。
構成員からは、次のような意見が出た。
▍日本人データの必要性について
⚫ 小児癌などの超希少疾患であっても全て日本人治験を行う必要がないとは
思わない。これから行われる国際共同治験であれば参加すべき。
⚫ 医療現場としては日本人症例は必要という感覚。超希少疾患で、海外で検
証的試験が実施済みであれば、日本人の治験がなくとも仕方ない感覚はあ
るが、治験の空洞化という意味での心配もある。
⚫ 少数例であっても国際共同治験に参加した経験を通じて、医療機関での経
験・ノウハウの蓄積に繋がった。一方で、経験・ノウハウの蓄積は別の方
法で培うべきであり、必ずしも規制によって促すべきではない。
⚫ 薬剤の特性、構造から民族差が想定されるかといった要素も考慮要素とし
て重要。日本人での用量を検討することは必要。PK データが必要になるこ
とはあるのではないか。
⚫ 統計的な解釈ができなくとも、日本人のデータがあることで医療現場・患
者の安心感に繋がる。基本的には必要なものであるという考え方は維持す
べき。
⚫ これまでは日本人のデータを求めてきたが、多くの医薬品部会上程品の場
合、外国人と同様の傾向である印象。
⚫ 既に海外で臨床試験が行われ、ラグになってしまっている医薬品について
は、さらに国内治験を行うことでラグが長期化してしまうことを避けるた
め、国内データは承認と並行して収集してもいいのではないか。
▍議論の対象について
⚫ 専門医のみが使用するような医薬品と、クリニックで幅広く使われる医薬
品では、考え方を分ける必要がある。
⚫ まずは超希少疾患という切り口で始めてもよいと思うが、将来的な方向性
も併せて議論すべき。ドラッグラグの解決が目的であれば、患者数ではな
く、臨床試験のフィージビリティの観点で定義するべき。
⚫ 抗がん剤の領域では、患者数が 1000 人いれば臨床試験が一定程度は実施可
能。500 人を下回るあたりから、試験の実施が困難になってくる印象。
⚫ 比較的ゆっくり状態を保てる疾患と、急激に状態が悪くなる疾患では取扱
いが異なるのでは。
⚫ 超希少疾患の定義をすることは難しいと思うが、総合判断をする場合であ
っても、どのような切り口で判断をするのか、考え方を示すことが重要。