よむ、つかう、まなぶ。
【資料5】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書(案) (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38892.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第9回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
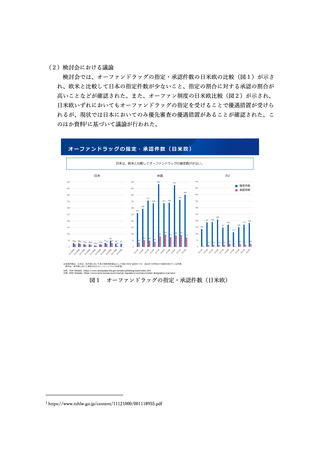
⚫ 研究機関の期待感としては、法改正後の実績がないことは、残念。
⚫ 製造販売後の計画は、期間を含めて具体化する必要がある。
⚫ 必ずしも条件付き承認制度を活用しなくとも、通常の安全性監視活動により
対応できる場合もあるのではないか。
また、第2回目の議論において、米国の迅速承認の取消品目のうち日本で製造販売
中の品目などが追加で示された13。
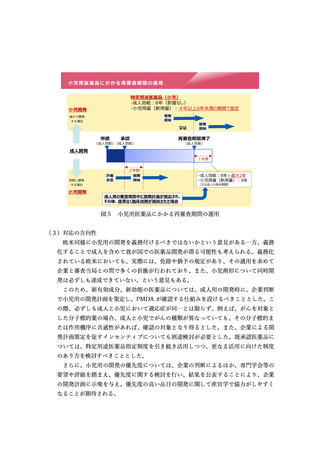
(3)対応の方向性
<検証的試験における日本人データの必要性の整理について>
ア.基本的考え方14
我が国での医薬品の承認審査においては、日本が参加した国際共同治験又は国内
試験の結果に基づいて、日本の医療環境下の日本人での有効性及び安全性を評価す
ることが基本であるとする考え方に変更はない。
また、国際共同治験については、日本人の組み入れ例数が極めて少数であっても、
臨床的観点も踏まえた総合的かつ多角的評価により、全体集団の成績とのある程度
の比較検討は可能であり、また、医療現場への情報提供等の観点からも、日本が参
加する意義はあると考えられる。少数例の国内試験についても同様に一定程度の意
義はあると考えられる。
ただし、海外で臨床開発が先行している医薬品については、日本で新たに治験を
実施することにより、さらに日本人患者の医薬品へのアクセスに時間を要する場合
がある。また、追加で日本人試験が求められることにより、日本での開発を断念し
ているケースもある。
このため、日本人での有効性・安全性を確保するとともに、治験の追加的な実施
によって日本人患者の医薬品へのアクセスが遅れる不利益を最小化する観点から、
日本人患者における臨床試験成績がなくとも薬事承認を行うことが適切であると考
えられる場合を整理する必要がある。
ただし、日本人患者における臨床試験成績がなく承認申請を行う場合であっても、
承認申請と並行して治験(拡大治験を含む)を開始し、日本人患者の投与実績に関
する情報を可能な限り収集し、審査において確認するとともに、医療現場へ情報提
供することが重要である。また、製造販売後調査等の実施等で日本人患者の投与実
績に関する情報が得られると判断される場合もある。
イ.日本人データなしに薬事申請を行う場合に考慮すべき要素
13
https://www.mhlw.go.jp/content/11121000/001206148.pdf
14
検討会での議論を踏まえ、検討会資料から記載の順序を変更している。
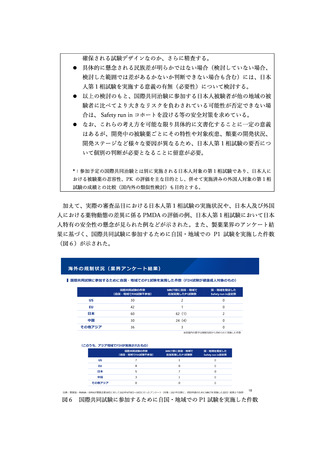
⚫ 製造販売後の計画は、期間を含めて具体化する必要がある。
⚫ 必ずしも条件付き承認制度を活用しなくとも、通常の安全性監視活動により
対応できる場合もあるのではないか。
また、第2回目の議論において、米国の迅速承認の取消品目のうち日本で製造販売
中の品目などが追加で示された13。
(3)対応の方向性
<検証的試験における日本人データの必要性の整理について>
ア.基本的考え方14
我が国での医薬品の承認審査においては、日本が参加した国際共同治験又は国内
試験の結果に基づいて、日本の医療環境下の日本人での有効性及び安全性を評価す
ることが基本であるとする考え方に変更はない。
また、国際共同治験については、日本人の組み入れ例数が極めて少数であっても、
臨床的観点も踏まえた総合的かつ多角的評価により、全体集団の成績とのある程度
の比較検討は可能であり、また、医療現場への情報提供等の観点からも、日本が参
加する意義はあると考えられる。少数例の国内試験についても同様に一定程度の意
義はあると考えられる。
ただし、海外で臨床開発が先行している医薬品については、日本で新たに治験を
実施することにより、さらに日本人患者の医薬品へのアクセスに時間を要する場合
がある。また、追加で日本人試験が求められることにより、日本での開発を断念し
ているケースもある。
このため、日本人での有効性・安全性を確保するとともに、治験の追加的な実施
によって日本人患者の医薬品へのアクセスが遅れる不利益を最小化する観点から、
日本人患者における臨床試験成績がなくとも薬事承認を行うことが適切であると考
えられる場合を整理する必要がある。
ただし、日本人患者における臨床試験成績がなく承認申請を行う場合であっても、
承認申請と並行して治験(拡大治験を含む)を開始し、日本人患者の投与実績に関
する情報を可能な限り収集し、審査において確認するとともに、医療現場へ情報提
供することが重要である。また、製造販売後調査等の実施等で日本人患者の投与実
績に関する情報が得られると判断される場合もある。
イ.日本人データなしに薬事申請を行う場合に考慮すべき要素
13
https://www.mhlw.go.jp/content/11121000/001206148.pdf
14
検討会での議論を踏まえ、検討会資料から記載の順序を変更している。