よむ、つかう、まなぶ。
【資料5】創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書(案) (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38892.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第9回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
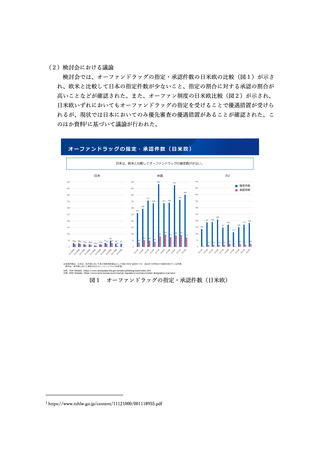
承認を適用する必要はないが、品目に応じて適宜適用を検討することが重要とされた。
また、「検証的臨床試験の実施が困難又は相当の時間を要する」との要件について
は、日本人の追加データが必要となる場合も該当することとする。また、致死的な疾
患や、急速かつ不可逆的に進行する疾患など、臨床試験の実施により医薬品の承認が
遅れることの患者への不利益の程度が大きい場合には要件に該当することとするなど、
幅広く解釈できるものとする。
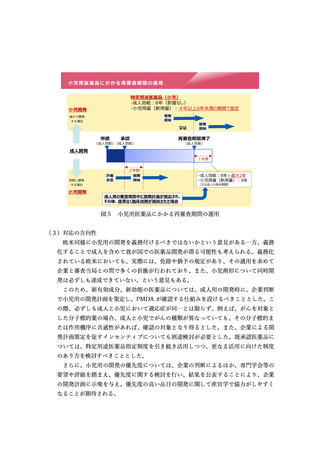
条件付き承認において承認後に実施する検証的臨床試験の対象患者については、必
ずしも条件付き承認を受けた範囲と完全に一致する必要はなく、臨床試験の実施可能
性を踏まえつつ、異なる治療ラインや、異なる疾患の進行段階であっても認められる
場合があるものとする。また、必ずしも日本人が含まれる必要はなく、海外で実施中
又は計画されている検証的臨床試験が認められる場合があるものとする。
なお、「検証的臨床試験の実施が困難又は相当の時間を要する」との要件のあり方
や、承認後の取消のあり方を含めた、条件付き承認の制度的枠組みのあり方について
は、引き続き、法改正の要否も含め、検討を進めるべきものとする。また、市販後の
評価に係る PMDA の体制強化についても、併せて検討を進めるべきものとする。
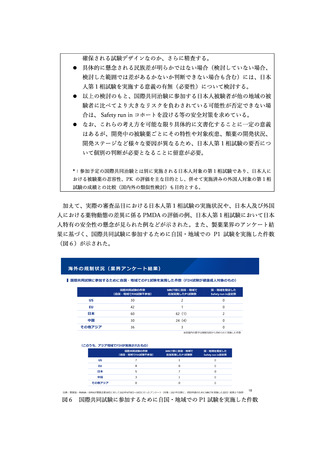
加えて、条件付き承認の活用を図るため、試行的なパイロット事業として、一つの
方策として、審査の過程でアカデミアや患者団体の意見を反映する仕組みについて研
究を進めるべきこととされた。
(4)検討会後の対応状況
検討会の議論を踏まえ、具体的な通知化に向けて、行政・業界間で議論が継続され
ている。
6.治験の更なる効率化(エコシステム)について【P】
7.製造販売後に実施する使用成績調査等のあり方及びリアルワールドデータの活用のあ
り方について【P】
8.医薬品の製造方法等に係る薬事審査等のあり方について
(1)背景
医薬品の製造についてグローバル化が進み、特定の製造所において製造された製品
が、世界各国に向けて出荷されることが通常となってきている。
医薬品の製造方法等は、堅牢で効率的な品質確保、安定供給等の観点から承認後も
製造販売業者、製造業者により随時見直しが行われるが、その変更内容に応じて、
国・地域ごとの規制当局の審査等を受ける必要がある。
このため、製造方法等の変更をしようとする場合は、全ての出荷先の規制当局に対
する手続を完了する必要があるが、欧米と比較して日本の変更手続は長期間を要する
また、「検証的臨床試験の実施が困難又は相当の時間を要する」との要件について
は、日本人の追加データが必要となる場合も該当することとする。また、致死的な疾
患や、急速かつ不可逆的に進行する疾患など、臨床試験の実施により医薬品の承認が
遅れることの患者への不利益の程度が大きい場合には要件に該当することとするなど、
幅広く解釈できるものとする。
条件付き承認において承認後に実施する検証的臨床試験の対象患者については、必
ずしも条件付き承認を受けた範囲と完全に一致する必要はなく、臨床試験の実施可能
性を踏まえつつ、異なる治療ラインや、異なる疾患の進行段階であっても認められる
場合があるものとする。また、必ずしも日本人が含まれる必要はなく、海外で実施中
又は計画されている検証的臨床試験が認められる場合があるものとする。
なお、「検証的臨床試験の実施が困難又は相当の時間を要する」との要件のあり方
や、承認後の取消のあり方を含めた、条件付き承認の制度的枠組みのあり方について
は、引き続き、法改正の要否も含め、検討を進めるべきものとする。また、市販後の
評価に係る PMDA の体制強化についても、併せて検討を進めるべきものとする。
加えて、条件付き承認の活用を図るため、試行的なパイロット事業として、一つの
方策として、審査の過程でアカデミアや患者団体の意見を反映する仕組みについて研
究を進めるべきこととされた。
(4)検討会後の対応状況
検討会の議論を踏まえ、具体的な通知化に向けて、行政・業界間で議論が継続され
ている。
6.治験の更なる効率化(エコシステム)について【P】
7.製造販売後に実施する使用成績調査等のあり方及びリアルワールドデータの活用のあ
り方について【P】
8.医薬品の製造方法等に係る薬事審査等のあり方について
(1)背景
医薬品の製造についてグローバル化が進み、特定の製造所において製造された製品
が、世界各国に向けて出荷されることが通常となってきている。
医薬品の製造方法等は、堅牢で効率的な品質確保、安定供給等の観点から承認後も
製造販売業者、製造業者により随時見直しが行われるが、その変更内容に応じて、
国・地域ごとの規制当局の審査等を受ける必要がある。
このため、製造方法等の変更をしようとする場合は、全ての出荷先の規制当局に対
する手続を完了する必要があるが、欧米と比較して日本の変更手続は長期間を要する