よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44832.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第8回 10/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
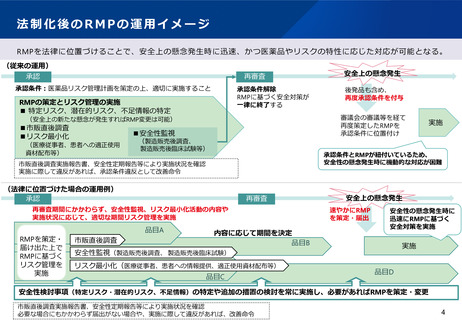
(1)リスクベースドアプローチの推進・RMP(医薬品リスク管理計
画)制度の見直し
背景・課題
•
承認時点では安全性情報が限られる品目や新たな技術を用いた医薬品が増えている中、収集された情報に基づく安全確保
措置に加えて、リスクベースの市販後安全対策を効果的に実施する必要がある。また、医薬品ライフサイクル全体を通じ
て、安全性に関する新たな知見に対応する必要がある。
•
平成26年10月よりGVP省令※の中に医薬品リスク管理計画(RMP)を位置づけて、RMPに基づく活動が必要な品目につい
ては、その作成を承認条件としている。しかし、承認条件は必要最小限のものであることが求められるため、再審査時に
RMPに基づく活動の実施内容を確認し、承認条件を解除する運用となっており、欧州に比べてやや硬直的な仕組みとなっ
ている。
•
RMP制度の見直しに当たっては、安全管理責任者の役割がますます重要となることから、法的位置づけの見直しを含めて
検討が必要である。
主な意見
※医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令
•
医薬品はそもそも未知のリスクがあり、また既知のリスクも最少化させるため、市販後収集された情報に基づく安全対策
の実施は重要である。必要な場合に、RMPの策定や変更を行い、医薬品ライフサイクル全体を通じて安全対策が実施され
るよう見直すことで、実効性のある制度にしていただきたい。
•
RMP全体が承認条件となっていることも増えており、企業によって内容やそれに対する対応もばらつきが出ているため、
見直しが必要であることには賛同する。ある程度形式化してしまっている部分もあるため、実践的安全対策にもっとRMP
が活用されるような制度にしていただきたい。
•
薬機法では、安全管理や品質保証の責任者として、原則、薬剤師という総責が規定されており、省令で総責は品責、安責
を監督し、その意見を尊重すると定められている。品責、安責を法に規定することによって、立場が同等になって責任が
分散してしまうのではないかという危惧がある。むしろ、責任役員と総責の責務を明確にしていく方向のほうが、法令遵
守も含めた全体の製販のガバナンス強化につながるものではないか。
•
安全管理の責任者である安責に関しては、やはり市販後の安全対策や承認条件従事に非常に重要であるが、未だに不満が
ある。安責が法律に位置づけられるという形式面だけではなく、今の時代に合った責任の在り方や、本当に機能するかと
いう観点で制度を考えていただきたい。
2
画)制度の見直し
背景・課題
•
承認時点では安全性情報が限られる品目や新たな技術を用いた医薬品が増えている中、収集された情報に基づく安全確保
措置に加えて、リスクベースの市販後安全対策を効果的に実施する必要がある。また、医薬品ライフサイクル全体を通じ
て、安全性に関する新たな知見に対応する必要がある。
•
平成26年10月よりGVP省令※の中に医薬品リスク管理計画(RMP)を位置づけて、RMPに基づく活動が必要な品目につい
ては、その作成を承認条件としている。しかし、承認条件は必要最小限のものであることが求められるため、再審査時に
RMPに基づく活動の実施内容を確認し、承認条件を解除する運用となっており、欧州に比べてやや硬直的な仕組みとなっ
ている。
•
RMP制度の見直しに当たっては、安全管理責任者の役割がますます重要となることから、法的位置づけの見直しを含めて
検討が必要である。
主な意見
※医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令
•
医薬品はそもそも未知のリスクがあり、また既知のリスクも最少化させるため、市販後収集された情報に基づく安全対策
の実施は重要である。必要な場合に、RMPの策定や変更を行い、医薬品ライフサイクル全体を通じて安全対策が実施され
るよう見直すことで、実効性のある制度にしていただきたい。
•
RMP全体が承認条件となっていることも増えており、企業によって内容やそれに対する対応もばらつきが出ているため、
見直しが必要であることには賛同する。ある程度形式化してしまっている部分もあるため、実践的安全対策にもっとRMP
が活用されるような制度にしていただきたい。
•
薬機法では、安全管理や品質保証の責任者として、原則、薬剤師という総責が規定されており、省令で総責は品責、安責
を監督し、その意見を尊重すると定められている。品責、安責を法に規定することによって、立場が同等になって責任が
分散してしまうのではないかという危惧がある。むしろ、責任役員と総責の責務を明確にしていく方向のほうが、法令遵
守も含めた全体の製販のガバナンス強化につながるものではないか。
•
安全管理の責任者である安責に関しては、やはり市販後の安全対策や承認条件従事に非常に重要であるが、未だに不満が
ある。安責が法律に位置づけられるという形式面だけではなく、今の時代に合った責任の在り方や、本当に機能するかと
いう観点で制度を考えていただきたい。
2