よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44832.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第8回 10/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
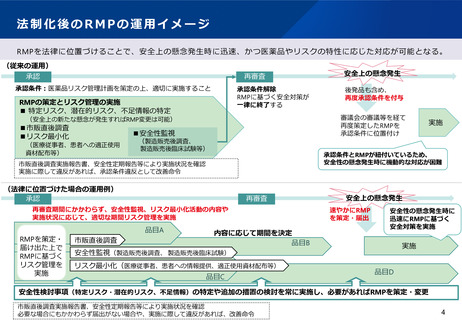
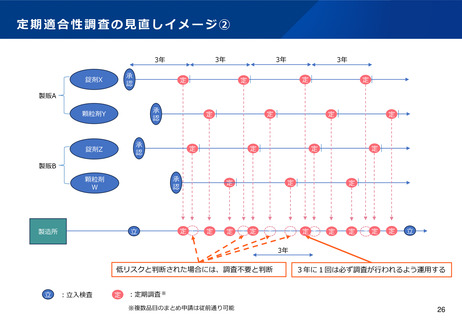
法制化後のRMPの運用イメージ
RMPを法律に位置づけることで、安全上の懸念発生時に迅速、かつ医薬品やリスクの特性に応じた対応が可能となる。
(従来の運用)
承認
再審査
承認条件:医薬品リスク管理計画を策定の上、適切に実施すること
承認条件解除
RMPに基づく安全対策が
一律に終了する
RMPの策定とリスク管理の実施
■ 特定リスク、潜在的リスク、不足情報の特定
■安全性監視
(医療従事者、患者への適正使用
資材配布等)
(製造販売後調査、
製造販売後臨床試験等)
(法律に位置づけた場合の運用例)
承認
再審査
再審査期間にかかわらず、安全性監視、リスク最小化活動の内容や
実施状況に応じて、適切な期間リスク管理を実施
品目A
市販直後調査
実施
承認条件とRMPが紐付いているため、
安全性の懸念発生時に機動的な対応が困難
市販直後調査実施報告書、安全性定期報告等により実施状況を確認
実施に際して違反があれば、承認条件違反として改善命令
RMPを策定・
届け出た上で
RMPに基づく
リスク管理を
実施
後発品も含め、
再度承認条件を付与
審議会の審議等を経て
再度策定したRMPを
承認条件に位置付け
(安全上の新たな懸念が発生すればRMP変更は可能)
■市販直後調査
■リスク最小化
安全上の懸念発生
内容に応じて期間を決定
品目B
安全上の懸念発生
速やかにRMP
を策定・届出
安全性の懸念発生時に
迅速にRMPに基づく
安全対策を実施
実施
安全性監視(製造販売後調査、 製造販売後臨床試験)
リスク最小化(医療従事者、患者への情報提供、適正使用資材配布等)
品目C
品目C
品目D
安全性検討事項(特定リスク・潜在的リスク、不足情報)の特定や追加の措置の検討を常に実施し、必要があればRMPを策定・変更
市販直後調査実施報告書、安全性定期報告等により実施状況を確認
必要な場合にもかかわらず届出がない場合や、実施に際して違反があれば、改善命令
4
RMPを法律に位置づけることで、安全上の懸念発生時に迅速、かつ医薬品やリスクの特性に応じた対応が可能となる。
(従来の運用)
承認
再審査
承認条件:医薬品リスク管理計画を策定の上、適切に実施すること
承認条件解除
RMPに基づく安全対策が
一律に終了する
RMPの策定とリスク管理の実施
■ 特定リスク、潜在的リスク、不足情報の特定
■安全性監視
(医療従事者、患者への適正使用
資材配布等)
(製造販売後調査、
製造販売後臨床試験等)
(法律に位置づけた場合の運用例)
承認
再審査
再審査期間にかかわらず、安全性監視、リスク最小化活動の内容や
実施状況に応じて、適切な期間リスク管理を実施
品目A
市販直後調査
実施
承認条件とRMPが紐付いているため、
安全性の懸念発生時に機動的な対応が困難
市販直後調査実施報告書、安全性定期報告等により実施状況を確認
実施に際して違反があれば、承認条件違反として改善命令
RMPを策定・
届け出た上で
RMPに基づく
リスク管理を
実施
後発品も含め、
再度承認条件を付与
審議会の審議等を経て
再度策定したRMPを
承認条件に位置付け
(安全上の新たな懸念が発生すればRMP変更は可能)
■市販直後調査
■リスク最小化
安全上の懸念発生
内容に応じて期間を決定
品目B
安全上の懸念発生
速やかにRMP
を策定・届出
安全性の懸念発生時に
迅速にRMPに基づく
安全対策を実施
実施
安全性監視(製造販売後調査、 製造販売後臨床試験)
リスク最小化(医療従事者、患者への情報提供、適正使用資材配布等)
品目C
品目C
品目D
安全性検討事項(特定リスク・潜在的リスク、不足情報)の特定や追加の措置の検討を常に実施し、必要があればRMPを策定・変更
市販直後調査実施報告書、安全性定期報告等により実施状況を確認
必要な場合にもかかわらず届出がない場合や、実施に際して違反があれば、改善命令
4