よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44832.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第8回 10/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
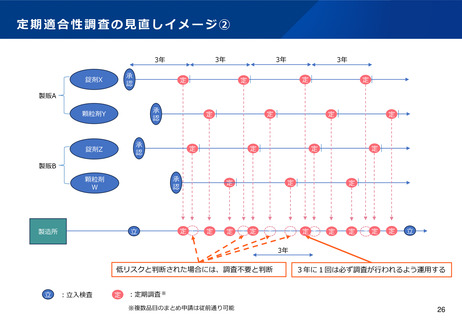
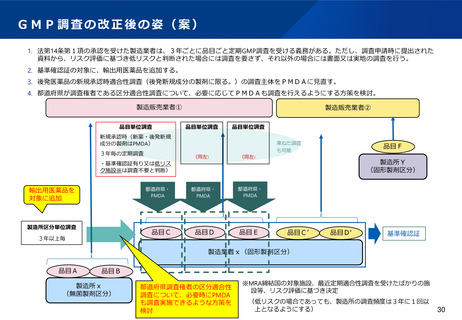
(5)全国的なGMP調査体制の構築
検討の方向性(案)
•
医療用後発医薬品(後発品として初めて承認を受ける成分を含有する品目に限る※)の製剤工程に係る新規承
認時の適合性調査については、製造管理・品質管理上の不備が発生するリスクが特に高く、その防止をより徹
底するためには、調査体制を確保し、調査員の研鑽に励みつつ日常的に不断の監視を実施している都道府県に
加え、複数の主体による調査を行うことが望ましいこと、承認審査業務との連携がより重要となることなどを
踏まえ、当該調査はPMDAが実施することとし、その後の定期の適合性調査等は引き続き都道府県が実施する
こととしてはどうか。(政令改正にて対応)
※
•
制度部会での議論を踏まえ、調査主体をPMDAに変更する範囲を必要最小限に絞り込んだもの
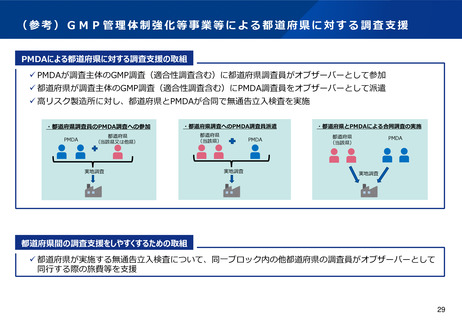
都道府県差を考慮し、都道府県の事情に応じて支援を行うため、都道府県が調査主体となる区分適合性調査に
ついて、必要時には都道府県に加え、PMDAも調査を行うことができるようにすることが必要。そのための具
体の方策については、法制的な対応も含め、更に検討することとしてはどうか。
28
検討の方向性(案)
•
医療用後発医薬品(後発品として初めて承認を受ける成分を含有する品目に限る※)の製剤工程に係る新規承
認時の適合性調査については、製造管理・品質管理上の不備が発生するリスクが特に高く、その防止をより徹
底するためには、調査体制を確保し、調査員の研鑽に励みつつ日常的に不断の監視を実施している都道府県に
加え、複数の主体による調査を行うことが望ましいこと、承認審査業務との連携がより重要となることなどを
踏まえ、当該調査はPMDAが実施することとし、その後の定期の適合性調査等は引き続き都道府県が実施する
こととしてはどうか。(政令改正にて対応)
※
•
制度部会での議論を踏まえ、調査主体をPMDAに変更する範囲を必要最小限に絞り込んだもの
都道府県差を考慮し、都道府県の事情に応じて支援を行うため、都道府県が調査主体となる区分適合性調査に
ついて、必要時には都道府県に加え、PMDAも調査を行うことができるようにすることが必要。そのための具
体の方策については、法制的な対応も含め、更に検討することとしてはどうか。
28