よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44832.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第8回 10/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
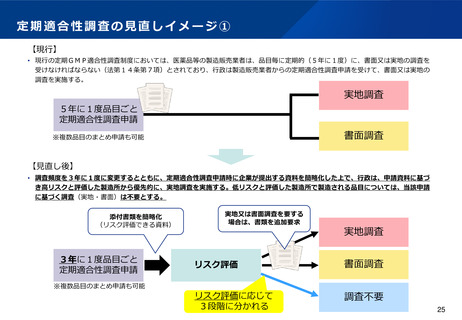
(4)適合性調査(GMP)の見直しについて
背景・課題
(より合理的なGMP調査体制の構築)
•
令和3年2月の小林化工(株)に対する行政処分をはじめとして、近年、後発医薬品の製造業者等を中心とした製造管理・
品質管理上の不正事案が続いており、医薬品関連事業者による法令遵守体制の一層の強化とともに、薬事監視体制の強化が
課題となっている。
•
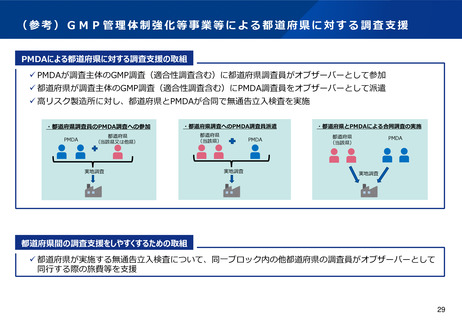
GMP適合性調査の実施主体であるPMDAや都道府県の査察リソースが限られる中で、リスクの高い製造所に対して、法第69
条による立入検査や、実地による法第14条第7項のGMP適合性調査を実施できるよう、メリハリをつけて調査を行う必要が
ある。特に、一連の不正事案の根本原因の一つとして挙げられる上流問題(製造開始時における製剤開発や工業化検討が不
十分)への薬事監視の観点での対応として、品質リスクが発生しやすい新薬や後発医薬品の新規品目に係る適合性調査につ
いては、確実に実地にて実施できるよう、査察リソースを集約・拡充したい。
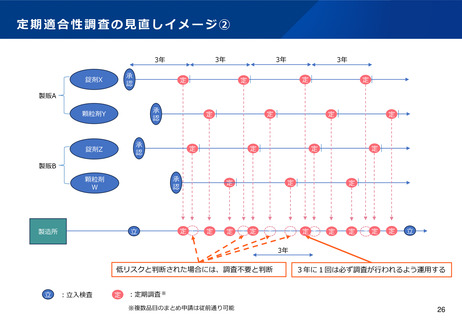
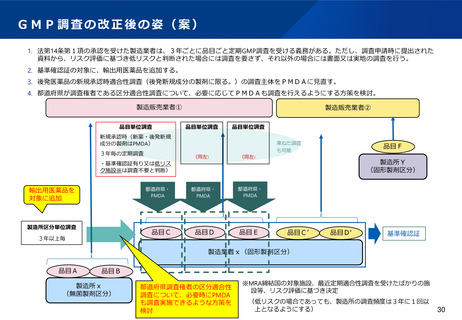
(基準確認証制度の合理化)
•
前回の法改正において国内流通品に係る定期のGMP調査については基準確認証制度が導入されたが、一方で輸出用医薬品は
基準確認証制度の対象外であることから、GMP調査の合理化が進んでおらず、また、そのためPMDA・都道府県のリソース
の有効活用も図られていないとの指摘がある。
主な意見
•
国際的に整合性のあるリスクベースのGMP適合性調査制度への見直しを要望する。また、国際的調和推進とグローバルサ
プライチェーンの効率化のため、製造所、製造工程ごとの基準確認証の利用範囲を拡大し、製造所単位でのGMP管理を進
めることを要望する。
•
リスクが高い製造業者に対して集約的に実地調査を実施する制度に見直す場合、リスクに関する基準をどのように設定す
るかについての検討が必要ではないか。
23
背景・課題
(より合理的なGMP調査体制の構築)
•
令和3年2月の小林化工(株)に対する行政処分をはじめとして、近年、後発医薬品の製造業者等を中心とした製造管理・
品質管理上の不正事案が続いており、医薬品関連事業者による法令遵守体制の一層の強化とともに、薬事監視体制の強化が
課題となっている。
•
GMP適合性調査の実施主体であるPMDAや都道府県の査察リソースが限られる中で、リスクの高い製造所に対して、法第69
条による立入検査や、実地による法第14条第7項のGMP適合性調査を実施できるよう、メリハリをつけて調査を行う必要が
ある。特に、一連の不正事案の根本原因の一つとして挙げられる上流問題(製造開始時における製剤開発や工業化検討が不
十分)への薬事監視の観点での対応として、品質リスクが発生しやすい新薬や後発医薬品の新規品目に係る適合性調査につ
いては、確実に実地にて実施できるよう、査察リソースを集約・拡充したい。
(基準確認証制度の合理化)
•
前回の法改正において国内流通品に係る定期のGMP調査については基準確認証制度が導入されたが、一方で輸出用医薬品は
基準確認証制度の対象外であることから、GMP調査の合理化が進んでおらず、また、そのためPMDA・都道府県のリソース
の有効活用も図られていないとの指摘がある。
主な意見
•
国際的に整合性のあるリスクベースのGMP適合性調査制度への見直しを要望する。また、国際的調和推進とグローバルサ
プライチェーンの効率化のため、製造所、製造工程ごとの基準確認証の利用範囲を拡大し、製造所単位でのGMP管理を進
めることを要望する。
•
リスクが高い製造業者に対して集約的に実地調査を実施する制度に見直す場合、リスクに関する基準をどのように設定す
るかについての検討が必要ではないか。
23