よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44832.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第8回 10/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
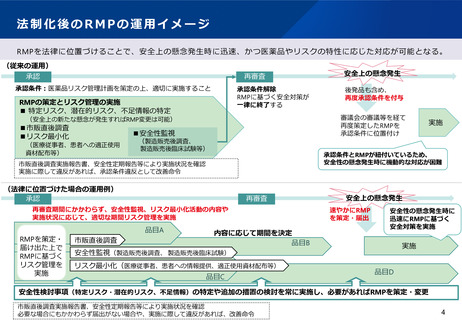
(1)リスクベースドアプローチの推進・RMP(医薬品リスク管理計
画)制度の見直し
検討の方向性(案)
•
医薬品について、承認時や製造販売後に得られた知見をもとに、製造販売業者が安全性検討事項に基づく追加
の安全性監視活動や追加のリスク最小化活動の必要性を検討し、必要な場合にRMPの策定や変更を行い、これ
に基づく活動が実施されるよう、RMPを承認条件として付すのではなく、その届出及び実施を薬機法で義務づ
けてはどうか。
•
RMPの届出が必要な場合としては、
①安全性について特に検討すべき事項に基づき、安全性情報を迅速かつ計画的に収集する必要がある
場合(例:新医薬品の中で必要なもの)
②安全性について特に検討すべき事項に基づき、リスク最小化活動を実施する必要がある場合
等としてはどうか。
•
RMPの実効性を担保するため、RMPの届出及び実施を怠った場合の改善命令、立入検査等の規定を設けるとと
もに、
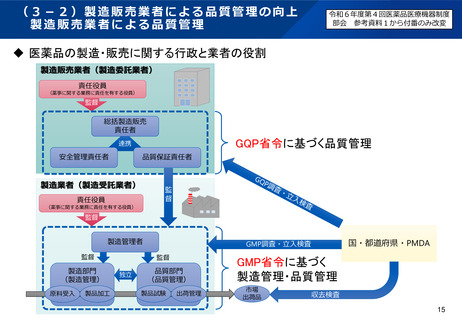
医薬品製造販売業者において、総括製造販売責任者が安全管理責任者を監督するという業務上の関係は維持し
つつ、医薬品リスク管理を含む安全確保業務を統括する安全管理責任者を医薬品医療機器等法に位置づけると
ともに、省令に安全管理責任者の遵守事項を規定してはどうか。
•
また、安全管理責任者が責任者として不適当と認められるときに、法令上の義務及び遵守事項を遵守するため
に必要な能力及び経験を有する者に変更することを命じられるよう、医薬品医療機器等法に規定する各種責任
者の変更命令の対象に医薬品製造販売業者の安全管理責任者を追加してはどうか。
3
画)制度の見直し
検討の方向性(案)
•
医薬品について、承認時や製造販売後に得られた知見をもとに、製造販売業者が安全性検討事項に基づく追加
の安全性監視活動や追加のリスク最小化活動の必要性を検討し、必要な場合にRMPの策定や変更を行い、これ
に基づく活動が実施されるよう、RMPを承認条件として付すのではなく、その届出及び実施を薬機法で義務づ
けてはどうか。
•
RMPの届出が必要な場合としては、
①安全性について特に検討すべき事項に基づき、安全性情報を迅速かつ計画的に収集する必要がある
場合(例:新医薬品の中で必要なもの)
②安全性について特に検討すべき事項に基づき、リスク最小化活動を実施する必要がある場合
等としてはどうか。
•
RMPの実効性を担保するため、RMPの届出及び実施を怠った場合の改善命令、立入検査等の規定を設けるとと
もに、
医薬品製造販売業者において、総括製造販売責任者が安全管理責任者を監督するという業務上の関係は維持し
つつ、医薬品リスク管理を含む安全確保業務を統括する安全管理責任者を医薬品医療機器等法に位置づけると
ともに、省令に安全管理責任者の遵守事項を規定してはどうか。
•
また、安全管理責任者が責任者として不適当と認められるときに、法令上の義務及び遵守事項を遵守するため
に必要な能力及び経験を有する者に変更することを命じられるよう、医薬品医療機器等法に規定する各種責任
者の変更命令の対象に医薬品製造販売業者の安全管理責任者を追加してはどうか。
3