よむ、つかう、まなぶ。
「医療機器及び体外診断用医薬品のリスク管理計画の策定及び公表について」の一部改正について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00011.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和4年度第1回 7/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
略(該当する項目名と変更内容の概要、変更の理由等)を記載した上で、変更部分に下線を引くととも
に、参考として変更内容の詳細を明記した資料(変更前後の内容を含む新旧対照表や修正履歴等)を併
せて提出すること。
第2
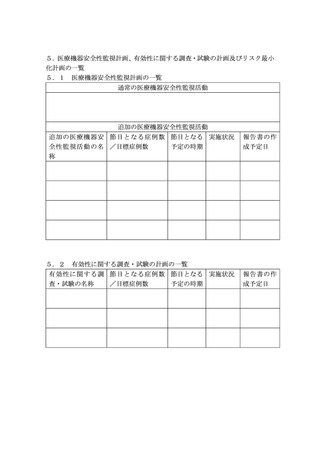
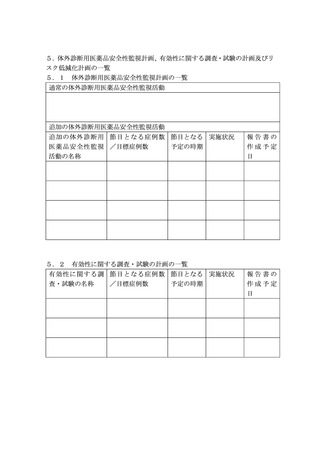
医療機器等リスク管理計画の公表について
1.公表の対象
(1)第1の3.又は5.に基づき、製造販売業者により総合機構へ提出された医療機器等リスク管理計
画のうち、品目の概要及び変更の履歴を含む表紙(提出者の印影、担当者の氏名及び連絡先を除く。
)
並びに「1.医療機器等リスク管理計画の概要」から「5.3リスク最小化計画の一覧」まで(以
下「公表資料」という。
)を公表の対象とする。
(2)なお、医療機器等リスク管理計画とともに提出された添付資料のうち、追加のリスク最小化活動と
して、医療従事者及び患者向けに作成・提供する資材(以下「資材」という。
)については、その資
材を一般に広く公表する必要が生じる場合には、関係学会や製造販売業者のホームページにおいて
公表することとする。
2.公表資料の作成
(1)公表資料は、表題を「○○○(販売名)に係る医療機器等リスク管理計画」とし、資料に記載され
た情報に係る権利及び内容についての責任は製造販売業者にある旨を明記した公表資料の表紙を付
すこと。なお、医療機器又は体外診断用医薬品の販売名が複数となる場合は、公表資料の表紙の表
題は、
「○○○(販売名)/△△△(販売名)に係る医療機器等リスク管理計画」とする等、それぞ
れの販売名を確認できるようにすること。
(2)複数の者が連名で一つの医療機器等リスク管理計画を総合機構に提出した場合は、公表資料につ
いても、同様に連名で作成すること。
(3)公表資料は、テキストベースのPDFファイルとし、コピープロテクトは施さないこと。
3.総合機構への公表資料の提出及び総合機構ウェブサイトへの掲載・削除
(1)医療機器等リスク管理計画が提出された後、総合機構は、製造販売業者に公表資料の電子ファイル
を提出するよう連絡する。製造販売業者は、総合機構から連絡を受けた後、原則5営業日以内に、
上記1.
(1)及び2.に基づき作成した公表資料を下記(2)により総合機構安全性情報・企画管
理部リスクコミュニケーション推進課宛(kikirmp@pmda.go.jp)に電子メールへの添付により提出
すること。
(2) 公表資料の提出は、以下によること。
・ 電子メールの本文に、提出者名、当該医療機器又は体外診断用医薬品の販売名、一般的名称、承
認番号及び承認年月日を記載すること。また、新規掲載・更新掲載の別についても記載すること。
・ファイル名は全て半角を用い、以下のようにすること。
業者コード
-
承認番号※
-
記号
-
版数
.拡張子
9桁
-
16 桁
-
RMP
-
2桁
.pdf
※1つの公表資料に複数の承認番号が含まれる場合は代表的な 1 つを使用する。
に、参考として変更内容の詳細を明記した資料(変更前後の内容を含む新旧対照表や修正履歴等)を併
せて提出すること。
第2
医療機器等リスク管理計画の公表について
1.公表の対象
(1)第1の3.又は5.に基づき、製造販売業者により総合機構へ提出された医療機器等リスク管理計
画のうち、品目の概要及び変更の履歴を含む表紙(提出者の印影、担当者の氏名及び連絡先を除く。
)
並びに「1.医療機器等リスク管理計画の概要」から「5.3リスク最小化計画の一覧」まで(以
下「公表資料」という。
)を公表の対象とする。
(2)なお、医療機器等リスク管理計画とともに提出された添付資料のうち、追加のリスク最小化活動と
して、医療従事者及び患者向けに作成・提供する資材(以下「資材」という。
)については、その資
材を一般に広く公表する必要が生じる場合には、関係学会や製造販売業者のホームページにおいて
公表することとする。
2.公表資料の作成
(1)公表資料は、表題を「○○○(販売名)に係る医療機器等リスク管理計画」とし、資料に記載され
た情報に係る権利及び内容についての責任は製造販売業者にある旨を明記した公表資料の表紙を付
すこと。なお、医療機器又は体外診断用医薬品の販売名が複数となる場合は、公表資料の表紙の表
題は、
「○○○(販売名)/△△△(販売名)に係る医療機器等リスク管理計画」とする等、それぞ
れの販売名を確認できるようにすること。
(2)複数の者が連名で一つの医療機器等リスク管理計画を総合機構に提出した場合は、公表資料につ
いても、同様に連名で作成すること。
(3)公表資料は、テキストベースのPDFファイルとし、コピープロテクトは施さないこと。
3.総合機構への公表資料の提出及び総合機構ウェブサイトへの掲載・削除
(1)医療機器等リスク管理計画が提出された後、総合機構は、製造販売業者に公表資料の電子ファイル
を提出するよう連絡する。製造販売業者は、総合機構から連絡を受けた後、原則5営業日以内に、
上記1.
(1)及び2.に基づき作成した公表資料を下記(2)により総合機構安全性情報・企画管
理部リスクコミュニケーション推進課宛(kikirmp@pmda.go.jp)に電子メールへの添付により提出
すること。
(2) 公表資料の提出は、以下によること。
・ 電子メールの本文に、提出者名、当該医療機器又は体外診断用医薬品の販売名、一般的名称、承
認番号及び承認年月日を記載すること。また、新規掲載・更新掲載の別についても記載すること。
・ファイル名は全て半角を用い、以下のようにすること。
業者コード
-
承認番号※
-
記号
-
版数
.拡張子
9桁
-
16 桁
-
RMP
-
2桁
※1つの公表資料に複数の承認番号が含まれる場合は代表的な 1 つを使用する。