よむ、つかう、まなぶ。
「医療機器及び体外診断用医薬品のリスク管理計画の策定及び公表について」の一部改正について (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00011.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和4年度第1回 7/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.製造販売後臨床試験実施計画書
(1)試験の目的(承認条件等の場合には、その旨を記載する。)
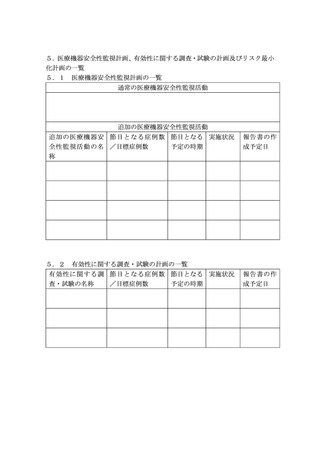
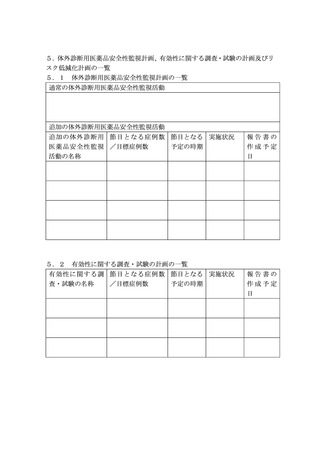
(2)安全性検討事項、有効性に関する検討事項
(3)試験の実施計画(案)
1)製造販売後臨床試験の依頼をしようとする者の氏名及び住所
2)試験に係る業務の一部を委託する場合にあっては、当該業務を受託した者の氏
名、住所及び当該業務の委託の範囲
3)実施医療機関の名称及び所在地(試験を予定する診療科別の施設数)
4)製造販売後臨床試験責任医師となるべき者の氏名及び職名
5)被験機器の概要
6)試験の方法
7)被験者の選定に関する事項(試験の対象患者)
8)試験を予定する症例数及び設定根拠
9)観察項目及び評価項目等の調査を行う事項
10)試験の実施予定期間
11)解析を行う項目及び方法
12)原資料の閲覧に関する事項
13)記録(データを含む。)の保存に関する事項
14)製造販売後臨床試験調整医師に委嘱した場合にあっては、その氏名及び職名
15)製造販売後臨床試験調整委員会に委嘱した場合にあっては、これを構成する医師
等の氏名及び職名
16)効果安全性評価委員会を設置したときは、その旨
17)製造販売後臨床試験の依頼をしようとする者は、当該製造販売後臨床試験の被験
者に対して製造販売後臨床試験機器が効果を有しないこと及び当該製造販売後臨
床試験への参加についてあらかじめ文書による説明と同意を得ることが困難な者
を対象にすることが予測される場合には、その旨及び次に掲げる事項
① 当該製造販売後臨床試験が、試験への参加についてあらかじめ文書による説明
と同意を得ることが困難と予測される者を対象にしなければならないことの説
明
② 当該製造販売後臨床試験において、予測される被験者への不利益が必要な最小
限度のものであることの説明
18)製造販売後臨床試験を依頼しようとする者は、当該製造販売後臨床試験が、試験
への参加についてあらかじめ文書による説明と同意及び代諾者の同意を得ることが
困難と予測される者を対象にしている場合には、その旨及び次に掲げる事項
① 現在における治療方法では被験者となるべき者の生命の危険が回避できる可能
性が十分にあることの説明
② 被験機器の使用により被験者となるべき者の生命の危険が回避できる可能性が
十分にあることの説明
③ 効果安全性評価委員会が設置されている旨
(1)試験の目的(承認条件等の場合には、その旨を記載する。)
(2)安全性検討事項、有効性に関する検討事項
(3)試験の実施計画(案)
1)製造販売後臨床試験の依頼をしようとする者の氏名及び住所
2)試験に係る業務の一部を委託する場合にあっては、当該業務を受託した者の氏
名、住所及び当該業務の委託の範囲
3)実施医療機関の名称及び所在地(試験を予定する診療科別の施設数)
4)製造販売後臨床試験責任医師となるべき者の氏名及び職名
5)被験機器の概要
6)試験の方法
7)被験者の選定に関する事項(試験の対象患者)
8)試験を予定する症例数及び設定根拠
9)観察項目及び評価項目等の調査を行う事項
10)試験の実施予定期間
11)解析を行う項目及び方法
12)原資料の閲覧に関する事項
13)記録(データを含む。)の保存に関する事項
14)製造販売後臨床試験調整医師に委嘱した場合にあっては、その氏名及び職名
15)製造販売後臨床試験調整委員会に委嘱した場合にあっては、これを構成する医師
等の氏名及び職名
16)効果安全性評価委員会を設置したときは、その旨
17)製造販売後臨床試験の依頼をしようとする者は、当該製造販売後臨床試験の被験
者に対して製造販売後臨床試験機器が効果を有しないこと及び当該製造販売後臨
床試験への参加についてあらかじめ文書による説明と同意を得ることが困難な者
を対象にすることが予測される場合には、その旨及び次に掲げる事項
① 当該製造販売後臨床試験が、試験への参加についてあらかじめ文書による説明
と同意を得ることが困難と予測される者を対象にしなければならないことの説
明
② 当該製造販売後臨床試験において、予測される被験者への不利益が必要な最小
限度のものであることの説明
18)製造販売後臨床試験を依頼しようとする者は、当該製造販売後臨床試験が、試験
への参加についてあらかじめ文書による説明と同意及び代諾者の同意を得ることが
困難と予測される者を対象にしている場合には、その旨及び次に掲げる事項
① 現在における治療方法では被験者となるべき者の生命の危険が回避できる可能
性が十分にあることの説明
② 被験機器の使用により被験者となるべき者の生命の危険が回避できる可能性が
十分にあることの説明
③ 効果安全性評価委員会が設置されている旨